摘要:用某氢氧燃料电池(用氢氧化钾水溶液为电解质溶液)电解饱和亚硫酸钠溶液一段时间.假设电解时温度不变且用惰性电极.下列说法正确的是 A.当燃料电池正极消耗mg气体时.电解池阴极同时有mg气体生成 B.电解池的阳极反应式为: 4OH--4e-=O2↑+2H2 C.电解池中溶液pH变小 D.燃料电池中溶液pH变大
网址:http://m.1010jiajiao.com/timu3_id_55335[举报]
用某氢氧燃料电池(用氢氧化钾水溶液为电解质溶液)电解饱和亚硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极。下列说法正确的是
![]() A.当燃料电池正极消耗mg气体时,电解池阴极同时有mg气体生成
A.当燃料电池正极消耗mg气体时,电解池阴极同时有mg气体生成
![]() B.电解池的阳极反应式为:
B.电解池的阳极反应式为: ![]()
![]() C.电解池中溶液pH变小
C.电解池中溶液pH变小
![]() D.燃料电池中溶液pH变大
D.燃料电池中溶液pH变大
氢、氮、氧三种元素可以分别两两组成如氮氧化物、氮氢化物和氢氧化物等,科学家们已经研究和利用其特殊性质开发其特有的功能.
(1)肼(N2H4)的制备方法之一是将NaClO溶液和NH3反应制得,试写出该反应的化学方程式
(2)肼可作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气.
N2(g)+2O2(g)=2NO2(g);△H=+67.7kJ?mol-1 N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ?mol-1
写出肼和NO2反应的热化学方程式:
(3)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的氢氧化钾溶液,反应生成N2和水蒸气.该电池放电时,负极的电极反应式为
(4)某文献报导了不同金属离子及其浓度对双氧水氧化降解海藻酸钠溶液反应速率的影响,实验结果如图1、图2所示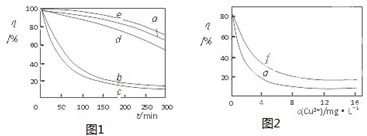
注:以上实验均在温度为20℃、w(H2O2)=0.25%、pH=7.12、海藻酸钠溶液浓度为8mg?L-1的条件下进行.图中曲线a:H2O2;b:H2O2+Cu2+; c:H2O2+Fe2+; d:H2O2+Zn2+;e:H2O2+Mn2+;图10中曲线f:反应时间为1h;g:反应时间为2h;两图中的纵坐标代表海藻酸钠溶液的粘度(海藻酸钠浓度与溶液粘度正相关).
由上述信息可知,下列叙述错误的是
A.锰离子能使该降解反应速率减缓
B.亚铁离子对该降解反应的催化效率比铜离子低
C.海藻酸钠溶液粘度的变化快慢可反映出其降解反应速率的快慢
D.一定条件下,铜离子浓度一定时,反应时间越长,海藻酸钠溶液浓度越小.
查看习题详情和答案>>
(1)肼(N2H4)的制备方法之一是将NaClO溶液和NH3反应制得,试写出该反应的化学方程式
NaClO+2NH3=N2H4+NaCl+H2O
NaClO+2NH3=N2H4+NaCl+H2O
.(2)肼可作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气.
N2(g)+2O2(g)=2NO2(g);△H=+67.7kJ?mol-1 N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ?mol-1
写出肼和NO2反应的热化学方程式:
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7kJ?mol-1;
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7kJ?mol-1;
.(3)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的氢氧化钾溶液,反应生成N2和水蒸气.该电池放电时,负极的电极反应式为
N2H4+4OH--4e-=N2+4H2O
N2H4+4OH--4e-=N2+4H2O
.(4)某文献报导了不同金属离子及其浓度对双氧水氧化降解海藻酸钠溶液反应速率的影响,实验结果如图1、图2所示

注:以上实验均在温度为20℃、w(H2O2)=0.25%、pH=7.12、海藻酸钠溶液浓度为8mg?L-1的条件下进行.图中曲线a:H2O2;b:H2O2+Cu2+; c:H2O2+Fe2+; d:H2O2+Zn2+;e:H2O2+Mn2+;图10中曲线f:反应时间为1h;g:反应时间为2h;两图中的纵坐标代表海藻酸钠溶液的粘度(海藻酸钠浓度与溶液粘度正相关).
由上述信息可知,下列叙述错误的是
B
B
(填序号).A.锰离子能使该降解反应速率减缓
B.亚铁离子对该降解反应的催化效率比铜离子低
C.海藻酸钠溶液粘度的变化快慢可反映出其降解反应速率的快慢
D.一定条件下,铜离子浓度一定时,反应时间越长,海藻酸钠溶液浓度越小.
氢、氮、氧三种元素可以分别两两组成如氮氧化物、氮氢化物和氢氧化物等,科学家们已经研究和利用其特殊性质开发其特有的功能。
(1)肼(N2H4)的制备方法之一是将NaClO溶液和NH3反应制得,试写出该反应的化学方程式_________________。
(2)肼可作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。
N2 + 2O2(g) = 2NO2(g);ΔH=+67.7 kJ·mol-1
N2H4 + O2(g) = N2(g) + 2H2O(g);ΔH=–534 kJ·mol-1
写出肼和NO2反应的热化学方程式____________________。
(3)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的氢氧化钾溶液。该电池放电时,负极的电极反应式为______________。
(4)过氧化氢的制备方法很多,下列方法中原子利用率最高的是______(填序号)。
A.BaO2 + H2SO4 = BaSO4 ↓ + H2O2
B.2NH4HSO4 (NH4)2S2O8 + H2↑;(NH4)2S2O8 + 2H2O = 2NH4HSO4 + H2O2
(NH4)2S2O8 + H2↑;(NH4)2S2O8 + 2H2O = 2NH4HSO4 + H2O2
C.CH3CHOHCH3 + O2→ CH3COCH3 + H2O2
D.乙基蒽醌法见下图
(1)肼(N2H4)的制备方法之一是将NaClO溶液和NH3反应制得,试写出该反应的化学方程式_________________。
(2)肼可作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。
N2 + 2O2(g) = 2NO2(g);ΔH=+67.7 kJ·mol-1
N2H4 + O2(g) = N2(g) + 2H2O(g);ΔH=–534 kJ·mol-1
写出肼和NO2反应的热化学方程式____________________。
(3)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的氢氧化钾溶液。该电池放电时,负极的电极反应式为______________。
(4)过氧化氢的制备方法很多,下列方法中原子利用率最高的是______(填序号)。
A.BaO2 + H2SO4 = BaSO4 ↓ + H2O2
B.2NH4HSO4
 (NH4)2S2O8 + H2↑;(NH4)2S2O8 + 2H2O = 2NH4HSO4 + H2O2
(NH4)2S2O8 + H2↑;(NH4)2S2O8 + 2H2O = 2NH4HSO4 + H2O2 C.CH3CHOHCH3 + O2→ CH3COCH3 + H2O2
D.乙基蒽醌法见下图
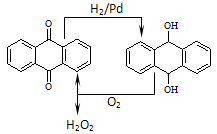
(5)根据本题(4)中B选项的方法,若要制得1mol H2O2,电解时转移电子数为______。
(6)某文献报导了不同金属离子及其浓度对双氧水氧化降解海藻酸钠溶液反应速率的影响,实验结果如图①、图②所示。
(6)某文献报导了不同金属离子及其浓度对双氧水氧化降解海藻酸钠溶液反应速率的影响,实验结果如图①、图②所示。
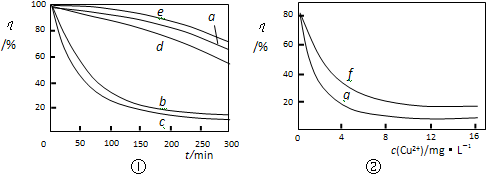
注:以上实验均在温度为20℃、w(H2O2)=0.25%、pH=7.12、海藻酸钠溶液浓度为8mg·L-1的条件下进行。
图①中曲线a:H2O2;b:H2O2+Cu2+;c:H2O2+Fe2+; d:H2O2+Zn2+;e:H2O2+Mn2+;
图②中曲线f:反应时间为1h;g:反应时间为2h;两图中的纵坐标代表海藻酸钠溶液的粘度(海藻酸钠浓度与溶液粘度正相关)。由上述信息可知,下列叙述错误的是_________(填序号)。
A.锰离子能使该降解反应速率减缓
B.亚铁离子对该降解反应的催化效率比铜离子低
C.海藻酸钠溶液粘度的变化快慢可反映出其降解反应速率的快慢
D.一定条件下,铜离子浓度一定时,反应时间越长,海藻酸钠溶液浓度越小
查看习题详情和答案>>
图①中曲线a:H2O2;b:H2O2+Cu2+;c:H2O2+Fe2+; d:H2O2+Zn2+;e:H2O2+Mn2+;
图②中曲线f:反应时间为1h;g:反应时间为2h;两图中的纵坐标代表海藻酸钠溶液的粘度(海藻酸钠浓度与溶液粘度正相关)。由上述信息可知,下列叙述错误的是_________(填序号)。
A.锰离子能使该降解反应速率减缓
B.亚铁离子对该降解反应的催化效率比铜离子低
C.海藻酸钠溶液粘度的变化快慢可反映出其降解反应速率的快慢
D.一定条件下,铜离子浓度一定时,反应时间越长,海藻酸钠溶液浓度越小
过度排放CO2会造成温室效应,最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把
CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。“绿色自由”构想技术流程如下
CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。“绿色自由”构想技术流程如下
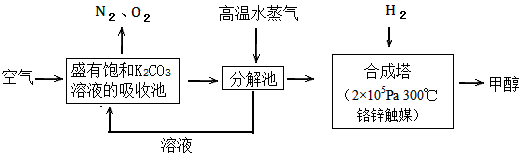
(1)写出吸收池中主要反应的离子方程式_________________;在合成塔中,若有2.2kgCO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式
________________。
(2)“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循环利用”的除碳酸钾溶液外,还包括________。
(3)甲醇可制作燃料电池。写出以氢氧化钾为电解质的甲醇燃料电池负极反应式________________。当电子转移的物质的量为________时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)工业上常以CO和H2为主要原料,生产甲醇。某密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)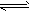 CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
________________。
(2)“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循环利用”的除碳酸钾溶液外,还包括________。
(3)甲醇可制作燃料电池。写出以氢氧化钾为电解质的甲醇燃料电池负极反应式________________。当电子转移的物质的量为________时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)工业上常以CO和H2为主要原料,生产甲醇。某密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)
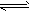 CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。 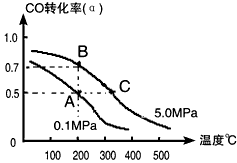
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数
K=__________;此时在B点时容器的体积VB________10L(填“大于”、“小于”或“等于”)。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA________tC(填“大于”、“小于”或“等于”)。
③在不改变反应物用量情况下,为提高CO转化率可采取的措施是______________(答出两点即可)。
查看习题详情和答案>>
K=__________;此时在B点时容器的体积VB________10L(填“大于”、“小于”或“等于”)。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA________tC(填“大于”、“小于”或“等于”)。
③在不改变反应物用量情况下,为提高CO转化率可采取的措施是______________(答出两点即可)。