网址:http://m.1010jiajiao.com/timu3_id_55319[举报]
(2)在一定条件下用普通铁粉和水蒸气反应可得到铁的氧化物,该氧化物可以被氢气还原,得到颗粒很细的铁粉,俗称“引火铁”.
写出普通铁粉和水蒸气反应的化学方程式
(3)通常情况下,氮气的化学性质不活泼,其原因是
在一定条件下,用普通铁粉和水蒸气反应,可以得到铁的氧化物,该氧化物又可以经此反应的逆反应,生成颗粒很细的铁粉。某校化学小组利用下图所列装置进行铁与水反应的实验,并利用产物进一步与四氧化三铁反应制取铁粉。(装置中的铁架台、铁夹等必要的夹持仪器在图中均已略去)
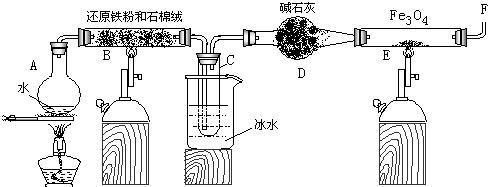
(1) 烧瓶A中常加入碎瓷片,其作用是 ,
小试管C的作用是 。
(2) 为了安全,在E管中的反应发生前,在F出口处必须 ,
E管中的反应开始后, 在F出口处应 。
(3) 反应3Fe +4H2O(g) ![]() Fe3O4 +4H2在一定条件下实际上为可逆反应,本实验中是如何实现Fe向Fe3O4的转变的?试用化学平衡移动原理加以解释
Fe3O4 +4H2在一定条件下实际上为可逆反应,本实验中是如何实现Fe向Fe3O4的转变的?试用化学平衡移动原理加以解释
。
(4) 停止反应,待B管冷却后,取其中固体加入过量稀盐酸,充分反应后过滤。简述证明滤液中
含有Fe3+的实验操作及现象
。
查看习题详情和答案>>
(1)实验进行时试管A中应加入的试剂是
(2)实验时,U型管G中应加入的试剂是
(3)两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母)
(4)烧瓶I中发生的反应有时要加入少量硫酸铜溶液,其目的是
(5)试管E中发生反应的化学方程式是
| ||
| ||
(6)为了安全,在E管中的反应发生前,在F出口处必须
(1)钢铁工业是国家工业的基础.请写出由CO还原赤铁矿的化学方程式:
(2)在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物.写出铁粉和水蒸气反应的化学方程式:
有机化合物香醇可以用作食用香精,其结构如图1所示:
(1)香醇的分子式为
①取代反应 ②加成反应 ③消去反应 ④聚合反应 ⑤氧化反应⑥水解反应
(2)有机物丙(C13H18O2)是一种香料,其合成路线如图2所示,其中甲的相对分子质量为88,它的核磁共振氢谱显示有3组峰,乙为香醇的同系物.

①A的名称是
②C与新制碱性Cu(OH)2反应的化学方程式
| △ |
| △ |
③丙中有两个甲基,在一定条件下,1mol D可以和2molH2反应生成乙,D可以发生银镜反应,则D的结构简式为


④甲与乙反应的化学方程式为


⑤甲的同分异构体中含有“一COO一”结构的共有