网址:http://m.1010jiajiao.com/timu3_id_54938[举报]
| 阴离子 | SO42-、NO3-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
②若向溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变
③若向溶液中加入BaCl2溶液,有白色沉淀生成.
试回答下列问题:
(1)原溶液中所含阳离子是(写离子符号,后同)
(2)若向原溶液中加入足量NaOH溶液,充分反应后静置一段时间,过滤、洗涤、灼烧,最终所得固体的质量是
(3)向原溶液中加入足量盐酸后,发生反应的离子方程式是
(4)用排水法收集所产生的气体并使气体恰好充满容器,仍将容器倒置于水槽中,再向容器中通入
| 1 |
| 22.4 |
| 1 |
| 22.4 |
某工厂的废渣中混有少量的锌粉和氧化铜(其它成分不跟酸反应),跟废盐酸接触形成污水。若向该污水中撒入铁粉,反应后铁粉有剩余,所得溶液中一定含有的金属离子是
| A.Fe2+、Cu2+ | B.Cu2+、Zn2+ | C.Zn2+、Fe2+ | D.Zn2+、Fe3+ |
某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
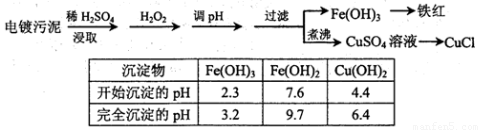
(1)酸浸后加入H2O2的目的是?????????? 。调pH步骤中加入的试剂最好是???????? (填化学式)。实验室进行过滤操作所用到的玻璃仪器有?????????????? 。
(2)煮沸CuSO4溶液的原因是????????????????? 。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式???????????? 。
(3)称取所制备的CuCl样品0.2500g置于一定量的0.5mol·L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液25.00mL。有关的化学反应为:Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+。计算该CuCl样品的质量分数?? 。
(4)Fe3+发生水解反应Fe3++3H2O Fe(OH)3+3H+,该反应的平衡常数表达式为??????????? 。
Fe(OH)3+3H+,该反应的平衡常数表达式为??????????? 。
查看习题详情和答案>>
某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
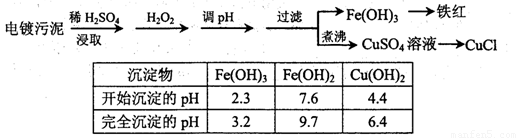
(1)酸浸后加入H2O2的目的是 。调pH步骤中加入的试剂最好是 (填化学式)。实验室进行过滤操作所用到的玻璃仪器有 。
(2)煮沸CuSO4溶液的原因是 。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式 。
(3)CuCl产品中CuCl的质量分数大于96.50%为国家合格标准。称取所制备的CuCl样品0.2500g置于一定量的0.5mol·L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液24.60mL。有关的化学反应为:
Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+。通过计算说明该CuCl样品 (填“符合”或“不符合”)国家标准。
(4)25℃时,KSP [Fe(OH)3]= 4.0×10-38。Fe3+发生水解反应Fe3++3H2O Fe(OH)3+3H+,该反应的平衡常数为
。
Fe(OH)3+3H+,该反应的平衡常数为
。
查看习题详情和答案>>