摘要:21A.B.C.D四种短周期元素的原子序数依次增大.A元素的气态氢化物与A元素的最高价氧化物对应的水化物能反应生成盐,B.C.D同周期.它们的最高价氧化物对应的水化物两两之间都能反应生成盐和水.B和D可组成化合物BD.回答下列问题: (1)A元素的气态氢化物的结构式为: .D的最高价氧化物对应水化物的化学式: . (2)在工业上常用 法制备单质C (3)C.D组成的化合物溶于水的离子方程式: . (4)B.C最高价氧化物对应的水化物在溶液中反应的离子方程式为: . 22已知A.B.C均为常见的单质.其中A为金属.B.C为非金属.在一定条件下相互转化关系如图所示(反应条件和部分产物已省略) 请回答: (1)若常温下B.C均为气体.D为黑色晶体.E的电子式为 .A和E在一定条件下反应生成D的化学方程式为 . (2)若常温下B为气体.C为黑色固体.则构成金属A的原子结构示意图为 .E的结构式为 .A和E在一定条件下反应生成D的化学方程式为 .
网址:http://m.1010jiajiao.com/timu3_id_54457[举报]
 已知A、B、C、D四种短周期元素在周期表中的相对位置如表,其中D的原子序数是A的原子序数的3倍.A与D组成的物质是一种超硬耐磨涂层材料,图为其晶体结构中最小的重复结构单元,其中的每个原子最外层均满足8电子稳定结构.下列有关说法正确的是( )
已知A、B、C、D四种短周期元素在周期表中的相对位置如表,其中D的原子序数是A的原子序数的3倍.A与D组成的物质是一种超硬耐磨涂层材料,图为其晶体结构中最小的重复结构单元,其中的每个原子最外层均满足8电子稳定结构.下列有关说法正确的是( ) 
查看习题详情和答案>>
现有A、B、C、D四种短周期元素,它们的相关结构和性质信息如下表所示,请结合相关信息,完成相关的问题:
(1)表中所述A的单质晶体中微粒间的相互作用有
(2)B元素的氧化物所对应的晶体属于
(3)钠与C元素形成的Na3C晶体中,C元素以C3-存在,C3-的电子排布式为
查看习题详情和答案>>
| 元素 | 相关结构和性质 |
| A | 其单质的一种晶体不是金属晶体,但是电的良导体,且难熔、质软并有润滑性,可用作原子核反应堆的慢化剂、火箭发动机喷灌和电极材料等. |
| B | 其单质既能与强酸溶液反应,又能与强碱溶液反应,其简单离子在第三周期单核离子中半径最小. |
| C | 是蛋白质的组成元素之一,原子核外有三种不同能量的电子,且未成对电子数最多. |
| D | 原子核外最外层电子排布式为nsnnp2n+1 |
共价键
共价键
、分子间作用力
分子间作用力
.(2)B元素的氧化物所对应的晶体属于
离子
离子
晶体(填“分子”、“原子”、“离子”、“金属”),工业上制备B元素单质的化学方程式:2Al2O3
4Al+3O2↑
| ||
2Al2O3
4Al+3O2↑
.
| ||
(3)钠与C元素形成的Na3C晶体中,C元素以C3-存在,C3-的电子排布式为
ls22s22p6
ls22s22p6
.C元素的气态氢化物溶于水后溶液呈碱性的原因(用方程式表示)NH3+H2O?NH3?H2O?NH4++OH-
NH3+H2O?NH3?H2O?NH4++OH-
(填序号).A、B、C、D四种短周期元素原子序数依次增大,A元素原子的价电子排列为ns2np2,B元素的最外层电子数是其电子层数的3倍,E元素原子的价电子排布为3d64s2.C、D的电离能数据如下(kJ?mol-1):
(1)化合价是元素的一种性质.由C、D的电离能数据判断,C通常显
(2)某单质甲分子与化合物AB分子中电子总数相等,则甲分子中包含
(3)AB的总键能大于甲的总键能,但AB比甲容易参加化学反应.根据下表数据,说明AB比甲活泼的原因是
 (4)E能与AB形成配合物,其中E提供
(4)E能与AB形成配合物,其中E提供
(5)如图所示晶胞中,阳离子与阴离子的个数为
查看习题详情和答案>>
| I1 | I2 | I3 | I4 | |
| C | 738 | 1451 | 7733 | 10540 |
| D | 577 | 1817 | 2745 | 11578 |
+2
+2
价,D显+3
+3
价;(2)某单质甲分子与化合物AB分子中电子总数相等,则甲分子中包含
1
1
个σ键,2
2
个π键;(3)AB的总键能大于甲的总键能,但AB比甲容易参加化学反应.根据下表数据,说明AB比甲活泼的原因是
断裂C≡O中的一个π键消耗的能量是273kJ/mol,断裂N≡N中的一个π键消耗的能量是523.3kJ/mol,断裂一个π键CO比N2更容易,所以CO更活泼
断裂C≡O中的一个π键消耗的能量是273kJ/mol,断裂N≡N中的一个π键消耗的能量是523.3kJ/mol,断裂一个π键CO比N2更容易,所以CO更活泼
.| 单键 | 双键 | 叁键 | ||
| AB | 键能(kJ?mol-1) | 357.7 | 798.9 | 1071.9 |
| 甲 | 键能(kJ?mol-1) | 154.8 | 418.4 | 941.7 |
 (4)E能与AB形成配合物,其中E提供
(4)E能与AB形成配合物,其中E提供空轨道
空轨道
,AB提供孤对电子
孤对电子
.(5)如图所示晶胞中,阳离子与阴离子的个数为
3:1
3:1
.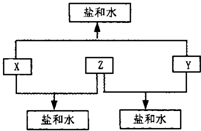 (2010?潍坊一模)已知:A、B、C、D四种短周期元素,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,试推断回答下列问题.
(2010?潍坊一模)已知:A、B、C、D四种短周期元素,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,试推断回答下列问题.(1)D元素原子的结构示意图为
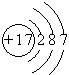
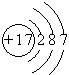
(2)A、B、C三种元素的原子半径由小到大的顺序为
N<Al<Na
N<Al<Na
(用元素符号表示);(3)Y与C元素的最高价氧化物可以发生反应,该反应的离子方程式为
Al2O3+2OH-+3H2O=2[Al(OH)4]-
Al2O3+2OH-+3H2O=2[Al(OH)4]-
;(4)A与D两元素的气态氢化物之间可以反应生成一种盐,该盐的水溶液呈
酸
酸
(填“酸”、“碱”或“中”)性,该水溶液中各离子浓度由小到大的顺序为c(OH-)<c(H+)<c(NH4+)<c(Cl-)
c(OH-)<c(H+)<c(NH4+)<c(Cl-)
(用具体离子符号表示);(5)实验室中,应将X的浓溶液保存在棕色试剂瓶中,其原因是
4HNO3(浓)
4NO2↑+O2↑+2H2O
| ||
4HNO3(浓)
4NO2↑+O2↑+2H2O
(用化学方程式表示).
| ||