摘要:(一)必考题 24.水是生命之源.也是化学反应中的明星物质.试回答下列问题: (1)写出水的电子式 . (2)A.B.C是中学化学常见的三种有色物质(其组成的元素均属短周期元素).摩尔质量依次增大.它们均能与水发生氧化还原反应.但水既不是氧化剂也不是还原剂.请写出A.B.C与水反应的化学方程式: A+H2O , B+H2O , C+H2O . 25.A.B.C.D常见的不同主族的短周期元素.它们的原子序数逐渐增大.其中只有一种是金属元素.D元素原子最外层电子数是C元素原子最外层电子数的二倍.B元素原子的最外层最子数比D的最外层电子数少两个.E也是短周期元素.与D同主族. (1)写出B元素符号 .画出E的原子结构示意图 . (2)由上述五种元素中的三种组成的易溶于水的物质中.能促进水电离物质M的化学式是 .其与水反应的离子方程式为 能抑制水电离的物质N的名称是 26.某溶液中可能含有CO.SO.HCO三种离子中的一种.两种或三种都有.为探究其组成.现取出两份相同的样品溶液中试管中.向一份中加入过量的盐酸.产生无色气泡,向另一份中滴加过量的氢氧化钡溶液.产生白色沉淀.请设计合理实验.在此实验的基础上做进上步实验.得出实验结论. 仅限选择的仪器.用品和试剂:烧杯.试管.玻璃棒.胶头滴管.量筒.集气瓶.铁架台.漏斗.滤纸.酒精灯.1mol/L硫酸.2mol/L盐酸.2mol/L硝酸.1mol/L氯化钡.1mol/L氢氧化钡.澄清石灰水.蒸馏水. 完成下列探究过程: (1)提出假设: 假设1:溶液只存在CO 假设2: . 假设3: . 假设4: . 假设5: . 假设6:溶液中存在CO.SO.HCO. (2)基于假设6.设计出实验方案.将实验操作.预期的实验现象和结论填在下表中.(可不填满.也可增加步骤) 步骤编号 实验步骤及预期现象和结论 ① ② ③ ④ 27..氨是重要的化工原料.合成氨是是哈伯1905年发明的.2001年希腊化学家提提出了电解合成氨的方法.即在常压下把氢气和用氦气稀释的氮气分别通入一个加热到57°C的电解池中.H2和N2在电极上合成氨.此法的转化率大为提高.已知: N2(g)+3H2(g) 2NH3(g) △H<0. 请回答下列问题: (1)电解法合成氨可以使用水做电解液吗? .为什么 . (2)若合成氨反应容器的容积为2L.开始充入3mol/LH2和1mol/LN2反应达到平衡时气体的压强变为原来的7/8.则氮气的转化率为 . 该反应的化学平衡常数的表达式为 .升高温度.平衡常数将 .,增大反应容器的体积.再达到平衡时.混合气体的平均分子量将 .. (3)在一这条件下氨可与其它物质反应生成尿素[CO(NH2)2].已知30g尿素在高温高压下分解生成11.2LNH3.5.6LCO2和一定质量的三聚氰胺分子(三聚氰胺的相对分子质量为126).不法分子曾在低蛋白含量的奶粉中加入三聚氰胺来提高奶粉中蛋白质含量.导致许多婴儿肾结石.写出三聚氰胺的分子式 .其化学反应方程式为 .三聚氰胺分子中有一个六元杯.一个三聚氰胺分子可分解生成三个分子A.则A的结构式是 . 28.A.B.C.D.E是中学化学常见的单质.其中只有A.C在常温下为气态.E的摩尔质量是A的2倍.F.G.H.I.J5种化合物分别由上述五种元素中的两种组成.D与F反应放出大量的热.它们之间的转化关系如下图所示: 请回答下列问题: (1)元素B在周期表的位置是:周期 .族 . (2)写出D与F反应的化学方程式 .该反应在工业生产中的用途是 . 已知H能与烧碱溶液反应.写出该反应的离子方程式 . (3)若J中含有B元素.写出检验化合物J中阳离子的有关离子方程式: .
网址:http://m.1010jiajiao.com/timu3_id_54325[举报]
水是生命之源,它与我们的生活密切相关.在化学实验中,水也是一种常用的试剂.
(1)水分子与H+形成水合氢离子( H3O+ )的立体构型为 .
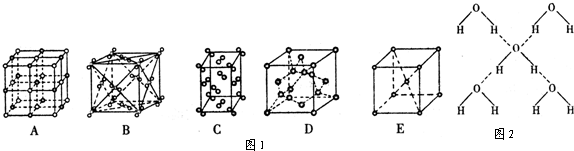
(2)冰是立方面心结构.下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞示意图(如图1)(未按顺序排序).上述五种晶体中与冰的晶体类型相同的是 ;(填写编号).
(3)在冰的晶体中,每个水分子与相邻的 4 个水分子形成氢键(如图2所示),已知冰的升华热(即 1mol 水由冰转化为水蒸汽所需能量)是51KJ/mol,除氢键外,水分子间还存在范德华力(11kJ/mol ),则冰晶体中氢键的“键能”(破坏 lmol氢键所需的能量即为氢键的“键能”)是 KJ/mol.
查看习题详情和答案>>

(1)水分子与H+形成水合氢离子( H3O+ )的立体构型为
(2)冰是立方面心结构.下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞示意图(如图1)(未按顺序排序).上述五种晶体中与冰的晶体类型相同的是
(3)在冰的晶体中,每个水分子与相邻的 4 个水分子形成氢键(如图2所示),已知冰的升华热(即 1mol 水由冰转化为水蒸汽所需能量)是51KJ/mol,除氢键外,水分子间还存在范德华力(11kJ/mol ),则冰晶体中氢键的“键能”(破坏 lmol氢键所需的能量即为氢键的“键能”)是
水是生命之源,也是化学反应中的主角.请回答下列问题:(下列问题所涉及的答案可能有多种,只需答出一种情况即可)
I.水是一种电解质,发生电离会产生电子总数相同的两种微粒,其电离的方程式为
Ⅱ.有以下五组离子①K+、Cl-、NO3-、S2-;②K+、Fe2+、I-、SO42-;③Na+、Cl-、NO3-、SO42-;
④Na+、Ca2+、Cl-、HCO3-;⑤K+、Ba2+、Cl-、NO3-.在由水电离产生的c(OHˉ)=1×10ˉ13mol/L溶液中,一定不能大量共存的离子组是
Ⅲ.在许多反应中H2O扮演不同的“角色”.请结合所学完成下列反应
(1)H2O参与的置换反应:
符合X+W→Y+V,已知X和Y分别是短周期同主族两种元素形成的单质,W、V是化合物
①W是水,离子方程式为
②V是水,化学方程式为
(2)水既不是氧化剂也不是还原剂的氧化还原反应:
A、B是中学化学常见的两种由短周期元素组成的有色气体,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,写出A、B与水反应的化学方程式:
①A+H2O
②B+H2O
查看习题详情和答案>>
I.水是一种电解质,发生电离会产生电子总数相同的两种微粒,其电离的方程式为
H2O+H2O=OH-+H3O+
H2O+H2O=OH-+H3O+
Ⅱ.有以下五组离子①K+、Cl-、NO3-、S2-;②K+、Fe2+、I-、SO42-;③Na+、Cl-、NO3-、SO42-;
④Na+、Ca2+、Cl-、HCO3-;⑤K+、Ba2+、Cl-、NO3-.在由水电离产生的c(OHˉ)=1×10ˉ13mol/L溶液中,一定不能大量共存的离子组是
④
④
(填序号)Ⅲ.在许多反应中H2O扮演不同的“角色”.请结合所学完成下列反应
(1)H2O参与的置换反应:
符合X+W→Y+V,已知X和Y分别是短周期同主族两种元素形成的单质,W、V是化合物
①W是水,离子方程式为
2Na+2H2O=2Na++2OH-+H2↑
2Na+2H2O=2Na++2OH-+H2↑
;②V是水,化学方程式为
O2+2H2S=2H2O+2S↓
O2+2H2S=2H2O+2S↓
.(2)水既不是氧化剂也不是还原剂的氧化还原反应:
A、B是中学化学常见的两种由短周期元素组成的有色气体,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,写出A、B与水反应的化学方程式:
①A+H2O
Cl2+H2O=HCl+HClO
Cl2+H2O=HCl+HClO
;②B+H2O
3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
.(1)298K、100kPa时,C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ?mol-1 2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ?mol-1 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ?mol-1,请写出298K时由C(s,石墨)和H2(g)生成1molC2H2(g)的热化学方程式
(2)水是生命之源,也是化学反应中的主角.试回答下列问题:A.B.C是中学化学常见的三种有色物质(其组成的元素均属短周期元素),它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,请写出A.B.C与水反应的化学方程式:
(3)写出硫化钠在水溶液中水解的离子方程式
(4)明矾可做净水剂是因为
(5)下列哪些事实能说明醋酸是弱酸
①醋酸不易腐蚀衣服;
②0.1mol/L的CH3COONa溶液的PH约为9;
③进行中和滴定时,等体积等物质的量浓度的H2SO4溶液比等体积等物质的量浓度的CH3COOH溶液消耗的NaOH溶液多;
④0.1mol/L的CH3COOH溶液PH约为2.9;
⑤相同体积的PH均等于4的盐酸和CH3COOH溶液,被同一物质的量浓度的NaOH溶液中和,CH3COOH溶液消耗的NaOH溶液多;
⑥镁粉与一定量稀硫酸反应,如果向其中加入少量醋酸钠可以降低反应速率但不改变产生气体的总量.
查看习题详情和答案>>
C(s,石墨)+H2(g)=C2H2(g)△H=226.7kJ?mol-1
C(s,石墨)+H2(g)=C2H2(g)△H=226.7kJ?mol-1
;(2)水是生命之源,也是化学反应中的主角.试回答下列问题:A.B.C是中学化学常见的三种有色物质(其组成的元素均属短周期元素),它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,请写出A.B.C与水反应的化学方程式:
3NO2+H2O=2HNO3+NO、Cl2+H2O=HCl+HClO、2Na2O2+2H2O=4NaOH+O2↑
3NO2+H2O=2HNO3+NO、Cl2+H2O=HCl+HClO、2Na2O2+2H2O=4NaOH+O2↑
;(3)写出硫化钠在水溶液中水解的离子方程式
S2-+H2O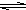 HS-+OH-
HS-+OH-
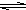 HS-+OH-
HS-+OH-S2-+H2O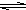 HS-+OH-
HS-+OH-
在配制硫化钠溶液时,为了防止发生水解,可以加入少量的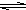 HS-+OH-
HS-+OH-NaOH
NaOH
;(4)明矾可做净水剂是因为
Al3+水解产生的胶状的Al(OH)3具有吸附性,可以吸附水中的杂质
Al3+水解产生的胶状的Al(OH)3具有吸附性,可以吸附水中的杂质
,有关的离子方程式为Al3++3H2O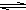 Al(OH)3+3H+有无色气体和白色絮状沉淀产生
Al(OH)3+3H+有无色气体和白色絮状沉淀产生
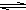 Al(OH)3+3H+有无色气体和白色絮状沉淀产生
Al(OH)3+3H+有无色气体和白色絮状沉淀产生Al3++3H2O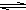 Al(OH)3+3H+有无色气体和白色絮状沉淀产生
Al(OH)3+3H+有无色气体和白色絮状沉淀产生
;向明矾的水溶液中加入饱和的小苏打溶液,则观察到的现象是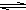 Al(OH)3+3H+有无色气体和白色絮状沉淀产生
Al(OH)3+3H+有无色气体和白色絮状沉淀产生有无色气体和白色絮状沉淀产生
有无色气体和白色絮状沉淀产生
,有关的离子方程式3HCO3-+Al3+=Al(OH)3↓+CO2↑
3HCO3-+Al3+=Al(OH)3↓+CO2↑
;(5)下列哪些事实能说明醋酸是弱酸
②④⑤⑥
②④⑤⑥
①醋酸不易腐蚀衣服;
②0.1mol/L的CH3COONa溶液的PH约为9;
③进行中和滴定时,等体积等物质的量浓度的H2SO4溶液比等体积等物质的量浓度的CH3COOH溶液消耗的NaOH溶液多;
④0.1mol/L的CH3COOH溶液PH约为2.9;
⑤相同体积的PH均等于4的盐酸和CH3COOH溶液,被同一物质的量浓度的NaOH溶液中和,CH3COOH溶液消耗的NaOH溶液多;
⑥镁粉与一定量稀硫酸反应,如果向其中加入少量醋酸钠可以降低反应速率但不改变产生气体的总量.
水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.
(1)水分子中氧原子核外电子排布图为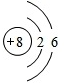
 ;
;
(2)写出与H2O分子互为等电子体的微粒
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+).下列对上述过程的描述不合理的是
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(4)在冰晶体中,以一个水分子为中心,画出水分子间最基本的连接方式(水分子用结构式表示);
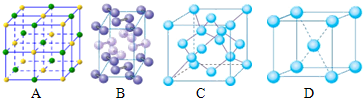
(5)如图是钾、碘、金刚石、氯化钠晶体的晶胞图(未按顺序排序).与冰的晶体类型相同的是
查看习题详情和答案>>
(1)水分子中氧原子核外电子排布图为


(2)写出与H2O分子互为等电子体的微粒
H2S、NH2-
H2S、NH2-
(填2种);(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+).下列对上述过程的描述不合理的是
A
A
;A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(4)在冰晶体中,以一个水分子为中心,画出水分子间最基本的连接方式(水分子用结构式表示);
(5)如图是钾、碘、金刚石、氯化钠晶体的晶胞图(未按顺序排序).与冰的晶体类型相同的是
B
B
,D晶体的空间利用率为68%
68%
.