网址:http://m.1010jiajiao.com/timu3_id_54198[举报]
能源是人类生存和发展的重要支柱。研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义。已知下列热化学方程式
①2H2(g)+O2(g)=2H2O(l) ![]() H=-570kJ/mol;
H=-570kJ/mol;
②H2(g)+1/2O2(g)=H2O(g) ![]() H=-242kJ/mol;
H=-242kJ/mol;
③C(s)+1/2O2(g)=CO(g) ![]() H= —110.5kJ/moL;
H= —110.5kJ/moL;
④C(s)+O2(g)=CO2(g) ![]() H= —393.5kJ/moL;
H= —393.5kJ/moL;
⑤CO2(g)+2H2O(g)=2CH4(g)+2 O2(g) ![]() H= +890kJ/moL
H= +890kJ/moL
回答下列问题
(1)上述反应中属于吸热反应的是
(2)H2的燃烧热为 。
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测定,但可通过间接的方法求得。已知C(s) + H2O(g)= H2(g)+ CO(g) ![]() H=akJ/moL;
H=akJ/moL;
则a= ;该反应的熵![]() S 0(选填“>”、“=”、“<”);已知自由能
S 0(选填“>”、“=”、“<”);已知自由能![]() G=
G=![]() H—T
H—T![]() S,当
S,当![]() G<0时可自发进行。则该反应在什么条件下可自发进行 。
G<0时可自发进行。则该反应在什么条件下可自发进行 。
能源是人类生存和发展的重要支柱。研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义。已知下列热化学方程式
①2H2(g)+O2(g)=2H2O(l) ![]() H=-570kJ/mol;
H=-570kJ/mol;
②H2(g)+1/2O2(g)=H2O(g) ![]() H=-242kJ/mol;
H=-242kJ/mol;
③C(s)+1/2O2(g)=CO(g) ![]() H= —110.5kJ/moL;
H= —110.5kJ/moL;
④C(s)+ O2(g)=CO2(g) ![]() H= —393.5kJ/moL;
H= —393.5kJ/moL;
⑤CO2(g)+2H2O(g)=2CH4(g)+2 O2(g) ![]() H= +890kJ/moL
H= +890kJ/moL
回答下列问题
(1)上述反应中属于吸热反应的是
(2)H2的燃烧热为 。
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测定,但可通过间接的方法求得。已知C(s) + H2O(g)= H2(g)+ CO(g) ![]() H=akJ/moL;
H=akJ/moL;
则a= ;该反应的熵![]() S 0(选填“>”、“=”、“<”);已知自由能
S 0(选填“>”、“=”、“<”);已知自由能![]() G=
G=![]() H—T
H—T![]() S,当
S,当![]() G<0时可自发进行。则该反应在什么条件下可自发进行 。
G<0时可自发进行。则该反应在什么条件下可自发进行 。
(4分)能源是人类生存和发展的重要支柱。研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义。已知下列热化学方程式:
① 2H2(g)+O2(g)=2H2O(l) ; ![]() H=-570 kJ·mol-1;
H=-570 kJ·mol-1;
② H2(g)+1/2O2(g)=H2O(g); ![]() H=-242 kJ·mol-1
H=-242 kJ·mol-1
③ C(s)+1/2O2(g)=CO(g) ;![]() H= —110.5 kJ·mol-1
H= —110.5 kJ·mol-1
④ C(s)+O2(g)=CO2(g) ; ![]() H=-393.5 kJ·mol-1
H=-393.5 kJ·mol-1
⑤ CO2(g) +2H2O(g)=2CH4(g)+2 O2(g) ;![]() H= +890 kJ·mol-1
H= +890 kJ·mol-1
回答下列问题:
(1)上述反应中属于吸热反应的是
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测定,但可通过间接的方法求得。已知C(s) + H2O(g)= H2(g)+CO (g) ![]() H=a kJ·mol-1;则a= ;该反应的熵
H=a kJ·mol-1;则a= ;该反应的熵![]() S 0(选填“>”、“=”、“<”)。
S 0(选填“>”、“=”、“<”)。
查看习题详情和答案>>
(4分)能源是人类生存和发展的重要支柱。研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义。已知下列热化学方程式:
① 2H2(g)+O2(g)=2H2O(l) ;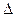 H=-570 kJ·mol-1;
H=-570 kJ·mol-1;
② H2(g)+1/2O2(g)=H2O(g) ;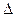 H="-242" kJ·mol-1
H="-242" kJ·mol-1
③ C(s)+1/2O2(g)="CO(g) " ;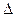 H= —110.5 kJ·mol-1
H= —110.5 kJ·mol-1
④C(s)+O2(g)=CO2(g) ; 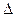 H=-393.5 kJ·mol-1
H=-393.5 kJ·mol-1
⑤ CO2(g) +2H2O(g)=2CH4(g) +2 O2(g) ;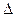 H= +890 kJ·mol-1
H= +890 kJ·mol-1
回答下列问题:
(1)上述反应中属于吸热反应的是
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测定,但可通过间接的方法求得。已知C(s) + H2O(g)= H2(g)+ CO (g) 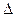 H="a" kJ·mol-1;则a= ;该反应的熵
H="a" kJ·mol-1;则a= ;该反应的熵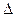 S 0(选填“>”、“=”、“<”)。
S 0(选填“>”、“=”、“<”)。
(4分)能源是人类生存和发展的重要支柱。研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义。已知下列热化学方程式:
① 2H2(g)+O2(g)=2H2O(l)
; 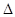 H=-570 kJ·mol-1;
H=-570 kJ·mol-1;
② H2(g)+1/2O2(g)=H2O(g)
; 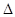 H=-242 kJ·mol-1
H=-242 kJ·mol-1
③ C(s)+1/2O2(g)=CO(g) ;
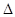 H= —110.5 kJ·mol-1
H= —110.5 kJ·mol-1
④ C(s)+O2(g)=CO2(g)
; 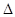 H=-393.5 kJ·mol-1
H=-393.5 kJ·mol-1
⑤ CO2(g) +2H2O(g)=2CH4(g)
+2 O2(g) ;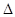 H= +890 kJ·mol-1
H= +890 kJ·mol-1
回答下列问题:
(1)上述反应中属于吸热反应的是
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测定,但可通过间接的方法求得。已知C(s) + H2O(g)= H2(g)+
CO (g) 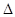 H=a kJ·mol-1;则a= ;该反应的熵
H=a kJ·mol-1;则a= ;该反应的熵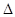 S
0(选填“>”、“=”、“<”)。
S
0(选填“>”、“=”、“<”)。
查看习题详情和答案>>