摘要:[考纲解读]1.了解相对原子质量.相对分子质量的定义.并能进行有关计算.2.了解原子构成.了解原子序数.核电荷数.质子数.中子数.核外电子数以及它们之间的相互关系. [能力解读]1.在理解概念的基础上.能进行计算并灵活应用.
网址:http://m.1010jiajiao.com/timu3_id_54148[举报]
(1)了解一些用药常识,有利于自我保健.现有下列药物:碳酸镁、青霉素、阿司匹林.
①其中属于解热镇痛的药物是
③碳酸镁可治疗胃酸过多的原理是
④药片常用淀粉作为黏合剂,淀粉水解的最终产物是
⑤用盐酸酸化的碘化钾淀粉溶液可检验食盐中是否含有碘酸钾,反应的化学方程式为:5KI+KIO3+6HCl═6KCl+3I2+3H2O
则此反应中的氧化剂是
(2)材料是人类赖以生存和发展的重要物质基础.
①住宅建设需大量的建筑材料.下列物质不属于硅酸盐材料的是
a.水泥 b.石灰石 c.玻璃
②现代生活离不开金属材料.下列钢铁的防腐方法中,防腐效果最好,但相对费用也最贵的是
a.涂油漆 b.包塑料层(镀塑) c.制成不锈钢
③塑料制品造成的环境问题通常称为
(3)①铁锈的主要成分是
②为了减少煤燃烧产生的SO2对大气造成的污染,可向煤中加入适量石灰石.石灰石与煤燃烧时产生的SO2及空气中的O2反应,生成CaSO4和CO2,写出该反应的化学方程式:
查看习题详情和答案>>
①其中属于解热镇痛的药物是
阿司匹林
阿司匹林
. ②能杀菌消炎药物是青霉素
青霉素
.③碳酸镁可治疗胃酸过多的原理是
MgCO3+H+═Mg2++H2O+CO2↑
MgCO3+H+═Mg2++H2O+CO2↑
(用离子方程表示).④药片常用淀粉作为黏合剂,淀粉水解的最终产物是
葡萄糖
葡萄糖
.⑤用盐酸酸化的碘化钾淀粉溶液可检验食盐中是否含有碘酸钾,反应的化学方程式为:5KI+KIO3+6HCl═6KCl+3I2+3H2O
则此反应中的氧化剂是
KIO3
KIO3
(填化学式),检验加碘盐时可观察到的实验现象是溶液变蓝色
溶液变蓝色
.(2)材料是人类赖以生存和发展的重要物质基础.
①住宅建设需大量的建筑材料.下列物质不属于硅酸盐材料的是
b
b
(填字母).a.水泥 b.石灰石 c.玻璃
②现代生活离不开金属材料.下列钢铁的防腐方法中,防腐效果最好,但相对费用也最贵的是
b
b
(填字母).a.涂油漆 b.包塑料层(镀塑) c.制成不锈钢
③塑料制品造成的环境问题通常称为
白色污染
白色污染
;(3)①铁锈的主要成分是
Fe2O3?xH2O
Fe2O3?xH2O
(写化学式),它是钢铁在潮湿的空气中发生电化学腐蚀的结果,其负极反应式为O2+4e-+2H2O=4OH-
O2+4e-+2H2O=4OH-
.②为了减少煤燃烧产生的SO2对大气造成的污染,可向煤中加入适量石灰石.石灰石与煤燃烧时产生的SO2及空气中的O2反应,生成CaSO4和CO2,写出该反应的化学方程式:
2CaCO3+2SO2+O2=2CaSO4+2CO2
2CaCO3+2SO2+O2=2CaSO4+2CO2
. 过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等.某化学兴趣小组同学围绕着过氧化氢开展了调查研究与实验.
过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等.某化学兴趣小组同学围绕着过氧化氢开展了调查研究与实验.Ⅰ.调查
(1)通过查阅资料,发现过氧化氢的沸点为152.1℃,而相对分子质量相同的硫化氢的沸点为-60.4℃,造成两者沸点差异大的主要原因是
过氧化氢分子间可以形成分子间氢键,而H2S不能形成氢键
过氧化氢分子间可以形成分子间氢键,而H2S不能形成氢键
;(2)资料显示,过氧化氢制备目前最常用的是乙基蒽醌法,其主要过程可以用如图所示,写出此过程的总反应方程式是
H2+O2
H2O2
| ||
H2+O2
H2O2
.
| ||
Ⅱ.不稳定性实验研究
(3)为了探究温度、催化剂等外界条件对H2O2的分解速率的影响,某兴趣小组同学设计了如下三组实验,部分实验数据已经填在下面表中.
| 实验编号 | T/℃ | H2O2初始浓度/ mol?L-1 |
FeCl3初始浓度/ mol?L-1 |
| Ⅰ | 20 | 1.0 | 0 0 |
| Ⅱ | 50 | 1.0 | 0 |
| Ⅲ | 50 | 1.0 1.0 |
0.1 |
0
0
mol?L-1,实验Ⅱ、Ⅲ研究催化剂对分解速率的影响,则实验Ⅲ中H2O2初始浓度应为1.0
1.0
mol?L-1.②三组实验中分解速率最快的是
Ⅲ
Ⅲ
(填编号).Ⅲ.过氧化氢含量的实验测定
兴趣小组同学用0.1000mol?L-1酸性高锰酸钾标准溶液滴定试样中过氧化氢的含量,反应原理为:2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2
(4)滴定到达终点的现象是
锥形瓶内溶液颜色恰好由无色变为浅紫色,且30秒内溶液不褪色
锥形瓶内溶液颜色恰好由无色变为浅紫色,且30秒内溶液不褪色
.(5)用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的 KMnO4标准溶液体积如下表所示:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
0.1800
0.1800
mol?L-1.(6)若滴定前尖嘴中有气泡,滴定后消失,则测定结果
偏高
偏高
(“偏高”或“偏低”或“不变”).已知一个N2O3分子质量为a(kg),一个N2O5分子的质量为b(kg),若以氧原子质量的1/16作为相对原子质量的标准,则NO2的相对分子质量是
.
查看习题详情和答案>>
| 8(b+a) |
| b-a |
| 8(b+a) |
| b-a |
(2013?绵阳模拟)在某锂离子电池中,有一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一(用M表示)的结构简式如图1:
用相对分子质量为56的单烯烃A合成M的 方法可设计如图2:
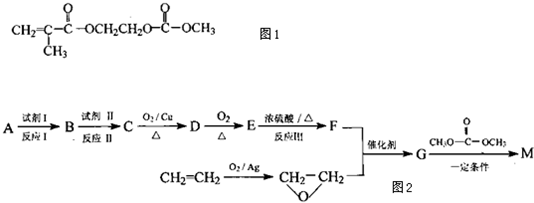
请回答下列问题:
(1)A的结构简式是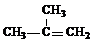
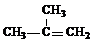 试剂Ⅱ是
试剂Ⅱ是
(2)G在一定条件下反应生成的高聚物是制备隐形眼镜的材料,请写出生成该高聚物的 化学反应方程式
(3)M与足量氯氧化钠溶液反应的化学方程式是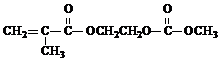 +3NaOH→
+3NaOH→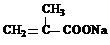 +HOCH2CH2OH+Na2CO3+CH3OH
+HOCH2CH2OH+Na2CO3+CH3OH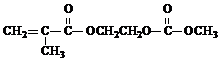 +3NaOH→
+3NaOH→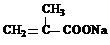 +HOCH2CH2OH+Na2CO3+CH3OH
+HOCH2CH2OH+Na2CO3+CH3OH
(4)在用E制备F的过程中,2分子的E反应会生成一种副产物,其核磁共振氢谱只有 一种吸收峰,该副产物的结构简式为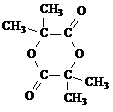
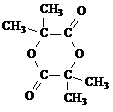 .
.
查看习题详情和答案>>
用相对分子质量为56的单烯烃A合成M的 方法可设计如图2:

请回答下列问题:
(1)A的结构简式是
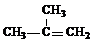
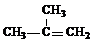
NaOH水溶液
NaOH水溶液
,反应Ⅲ的化学反应类型是消去反应
消去反应
.(2)G在一定条件下反应生成的高聚物是制备隐形眼镜的材料,请写出生成该高聚物的 化学反应方程式
n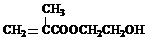
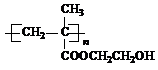
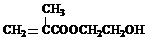
| 一定条件 |
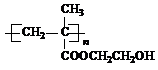
n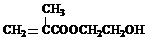
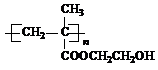
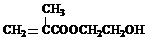
| 一定条件 |
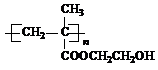
(3)M与足量氯氧化钠溶液反应的化学方程式是
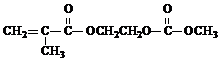 +3NaOH→
+3NaOH→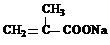 +HOCH2CH2OH+Na2CO3+CH3OH
+HOCH2CH2OH+Na2CO3+CH3OH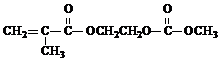 +3NaOH→
+3NaOH→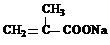 +HOCH2CH2OH+Na2CO3+CH3OH
+HOCH2CH2OH+Na2CO3+CH3OH(4)在用E制备F的过程中,2分子的E反应会生成一种副产物,其核磁共振氢谱只有 一种吸收峰,该副产物的结构简式为
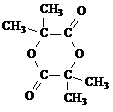
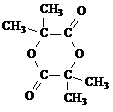
(2011?广东四校联考)(1)含氯消毒剂可防甲型H1N1流感.二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与Na2SO3反应制得.请写出反应的离子方程式
(2)某无色溶液只含有下列8种离子中的某几种:Na+、H+、Mg2+、Ag+、Cl-、OH-、HCO
、NO
.已知该溶液可与Al2O3反应,则:
①该溶液与Al2O3反应后有Al3+生成,则原溶液中一定含有
②该溶液与Al2O3反应后有AlO
生成,则原溶液中一定含有
③写出该溶液与Al2O3反应生成AlO
的离子方程式
查看习题详情和答案>>
2ClO3-+SO32-+2H+═2ClO2+SO42-+H2O
2ClO3-+SO32-+2H+═2ClO2+SO42-+H2O
(2)某无色溶液只含有下列8种离子中的某几种:Na+、H+、Mg2+、Ag+、Cl-、OH-、HCO
- 3 |
- 3 |
①该溶液与Al2O3反应后有Al3+生成,则原溶液中一定含有
H+
H+
,一定不会含有大量的OH-、HCO3-
OH-、HCO3-
.②该溶液与Al2O3反应后有AlO
- 2 |
OH-、Na+
OH-、Na+
,可能含有大量的Cl-、NO3-
Cl-、NO3-
.③写出该溶液与Al2O3反应生成AlO
- 2 |
Al2O3+2OH-═2AlO2-+H2O
Al2O3+2OH-═2AlO2-+H2O
.