摘要:20.直线上的点到圆上的点的最小距离为 .
网址:http://m.1010jiajiao.com/timu3_id_54081[举报]
煤经过化学加工可转化为气体或液体燃料以及各种化工产品,从而提高了煤的利用率.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.5kJ?mol-1
①在一体积为2L的密闭容器中,加入1mol C和2mol H2O(g),达平衡H2O(g)的转化率为20%,请计算此时的平衡常数
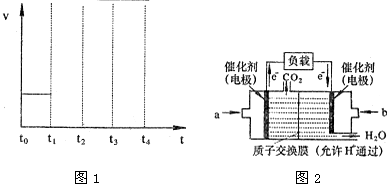
②若容器体积不变,反应在t0时达到平衡,平衡常数为K1;在t1时升高温度,t2重新达到平衡,平衡常数为K2;t3时充入水蒸气,t4时重新达到平衡;平衡常数为K3;请在下面的反应速率与时间关系图1中用直线画出t1到t4正反应速率的变化情况,并比较K1、K2、K3的数值 (用“>”、“<”或“=”)
③又知C(s)+CO2(g)?2CO(g)△H=+172.5kJ?mol-1,则CO(g)+H2O(g)?CO2(g)+H2(g)的焓变△H为
(2)CO与H2在一定条件下可反应生成甲醇,CO(g)+2H2(g)?CH3OH(g).甲醇是一种燃料,可用于设计燃料电池.图2是甲醇燃料电池的原理示意图,电解质溶液为稀硫酸.
①a处通入的是
②该电池工作过程中,H+的移动方向为从
查看习题详情和答案>>

(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.5kJ?mol-1
①在一体积为2L的密闭容器中,加入1mol C和2mol H2O(g),达平衡H2O(g)的转化率为20%,请计算此时的平衡常数
0.27
0.27
;②若容器体积不变,反应在t0时达到平衡,平衡常数为K1;在t1时升高温度,t2重新达到平衡,平衡常数为K2;t3时充入水蒸气,t4时重新达到平衡;平衡常数为K3;请在下面的反应速率与时间关系图1中用直线画出t1到t4正反应速率的变化情况,并比较K1、K2、K3的数值 (用“>”、“<”或“=”)
K1<K2=K3
K1<K2=K3
;③又知C(s)+CO2(g)?2CO(g)△H=+172.5kJ?mol-1,则CO(g)+H2O(g)?CO2(g)+H2(g)的焓变△H为
-41kJ?mol-1
-41kJ?mol-1
;(2)CO与H2在一定条件下可反应生成甲醇,CO(g)+2H2(g)?CH3OH(g).甲醇是一种燃料,可用于设计燃料电池.图2是甲醇燃料电池的原理示意图,电解质溶液为稀硫酸.
①a处通入的是
甲醇
甲醇
(填物质名称),左侧电极上发生的电极反应式为CH3OH+H2O-6e-=CO2+6H+
CH3OH+H2O-6e-=CO2+6H+
;②该电池工作过程中,H+的移动方向为从
左
左
到由
由
(填“左“或“右“).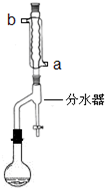 在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.
在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.★乙酸正丁酯的制备
在干燥的50ml圆底烧瓶中,加入11.5ml(0.125mol)正丁醇和7.2ml(0.125mol)冰醋酸,再加入3~4滴浓硫酸,摇匀,投入1-2粒沸石,按图安装带分水器的回流反应装置.
打开冷凝水,小火加热.在反应过程中,通过分水器下部的旋塞分出生成的水,注意保持分水器中水层液面原来的高度,使油层尽量回到圆底烧瓶中;反应达到终点后,停止加热.
★产品的精制
将圆底烧瓶中的液体倒入分液漏斗中,用10mL10%Na2CO3洗涤后将有机层倒入锥形瓶中,再用无水硫酸镁干燥.将干燥后的乙酸正丁酯滤入50ml的蒸馏瓶中蒸馏,收集124~126℃的馏分,得11.34g产品.
★回答问题
(1)写出制备乙酸正丁酯的化学方程式(用氧-18示踪原子说明断键情况)
(2)冷水应该从冷凝管
(3)本实验提高产品产率的方法是
(4)产品的精制过程中,用10mL10%Na2CO3洗涤的目的是
(5)该实验过程中,生成乙酸正丁酯的产率是
(6)其可能的副产物为
 化学对人类社会进步和发展的贡献之一是发现和研制了各种材料,无机非金属材料和金属材料在我们生活中有着极其广泛的用途.根据你学过的有关材料的知识,回答下列问题:
化学对人类社会进步和发展的贡献之一是发现和研制了各种材料,无机非金属材料和金属材料在我们生活中有着极其广泛的用途.根据你学过的有关材料的知识,回答下列问题:(1)下列材料中的
①光导纤维②铝合金 ③钢铁 ④晶体硅 ⑤高温结构陶瓷
粗硅的制备是以石英和焦炭为原料在高温发生反应而制得,该反应的化学方程式为
(2)青铜是我国使用最早的合金,铜钱在我国历史上曾经是一种广泛流通的货币.下列有关铜合金的说法正确的是
A.我国较早的掌握了湿法冶炼钢的技术
B.铜的性质不活泼,自然界有大量的游离态的铜
C.常见的铜合金除了青铜外还有黄铜和白铜
D.铜常用于制造货币的原因是铜合金的熔点较低,易于冶炼、铸造成型,且不易被腐蚀
(3)“纳米材料”是粒子直径为1nm~100nm的材料,纳米碳就是其中的一种.某研究所将纳米碳均匀的分散到蒸馏水中,得到的分散系:①是溶液 ②是胶体 ③具有丁达尔现象 ④不能透过滤纸 ⑤不能透过半透膜 ⑥静止后会出现黑色沉淀.其中正确的是