摘要:2.在100mL烧杯中加入30mL稀硫酸铜溶液.
网址:http://m.1010jiajiao.com/timu3_id_5245[举报]
实验室里有一瓶标签残缺的盐酸,请你来共同探究.
(1)
怎样立即确定它是不是浓盐酸?有人猜测是,有人记得好像不是,大家各抒己见.你认为,应该用下述的______方法(填选项编号)立即确认.|
A .讨论 |
B .调查 |
C .实验 |
D .上网 |
具体的做法是
__________________________________________.(2)
粗略测定每毫升该盐酸中含溶质HCl的质量.同学们依据酸和碱中和反应的原理,设计了一种可行的实验方案,其操作步骤如下:第
1步:在小烧杯中加入10g5%的NaOH溶液;第
2步:向上述烧杯中滴入2滴酚酞溶液;第
3步:向100mL量筒中注入该盐酸至一定刻度;第
4步:用胶头滴管吸取量筒中的盐酸.逐滴滴入上述烧杯中,直到烧杯中的溶液由红色变为无色为止;第
5步:记录实验数据;第
6步:计算,确定每毫升盐酸中含溶质HCl的质量.请根据以上实验过程,回答下列问题:
①本实验为什么要用指示剂
(酚酞)?答:
_______________________________________________.②第
3步中向量筒注入盐酸,量筒中的液面位置如图所示,A与B、B与C刻度间均相差1mL,如果刻度A为8,量筒中盐酸的体积是______mL.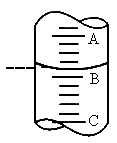
③第
4步要用到玻璃棒,它的作用是______,目的是___________.停止滴入盐酸后,胶头滴管中残留的盐酸应
________________________.④第
5步要记录的实验数据是___________________________________.(3)
测定每毫升该盐酸中含溶质HCl的质量,其原理和方法还有多种,为此大家继续进行探究.你能写出两种其他可行的方法吗?若能,请写在下面(用文字简述所依据的原理和要测定的数据,不需要写出化学方程式).方法一:
_____________________________________方法二:
_____________________________________ 查看习题详情和答案>>探究结晶速度影响析出晶体大小.
(1)在100mL烧杯中盛有50mL约80℃时的热水,加入硝酸钾固体,不断搅拌,直至加入硝酸钾固体不能再溶解为止;
(2)立即把制得的溶液分别等量地倒入3个烧杯中;
(3)其中一个烧杯立即放入盛有冷水的水槽里冷却,一个烧杯加热蒸发水分,另一个烧杯让它自然冷却,如图所示;
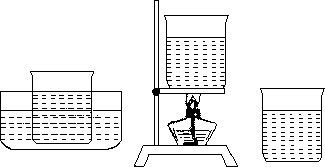
(4)在下表中记录实验现象

①在实验步骤(1)中配制成的溶液是不是80℃时的硝酸钾饱和溶液?
②析出晶体后的溶液是不是饱和溶液?
③要制得较大颗粒的晶体可采用的方法是什么?
查看习题详情和答案>> 26、请根据题目要求回答下列问题.
26、请根据题目要求回答下列问题.(1)使用托盘天平称物品的正确操作顺序为(填序号)
B
.①调游码;②放称量纸;③称量物放左盘.
④调零点⑤加质量大的砝码⑥加质量小的砝码
A.①②③④⑤⑥B.④②③⑤⑥①C.④⑤⑥①②③
(2)在小烧杯中加入硫酸铜溶液后,加入铁钉,称量总质量为m1,发生反应的实验现象为
铁钉表面有红色物质生成
,反应发生了一段时间后,再称量小烧杯及烧杯内物质的总质量为m2,则(填“=”“>”“<”)m1=
m2.(3)如图装置中,称量小烧杯中所有物质的质量为m1,然后将小烧杯中的碳酸钠与盐酸完全混合,反应
发生了一段时间后,再称量小烧杯及烧杯内物质的总质量为m2,则(填“=”“>”“<”)m1>m2,
原因是:
碳酸钠与盐酸反应放出二氧化碳气体
.34、实验室里有一瓶标签残缺的盐酸,请你来共同探究.
(1)怎样立即确定它是不是浓盐酸?有人猜测是,有人记得好像不是,大家各抒己见.你认为,应该用下述中的
A.讨论 B.调查 C.实验 D.上网
具体的做法是
(2)粗略测定该盐酸每毫升溶液中含溶质HCl的质量.同学们依据酸和碱中和反应的原理,设计了一种可行的实验方案,其操作步骤如下:
第1步,在小烧杯中加入10g 5%的NaOH溶液;
第2步,向上述烧杯中滴入2滴酚酞试液;
第3步,向10mL的量筒里注入该盐酸至一定刻度;
第4步,用胶头滴管吸取量筒中的盐酸,逐滴滴入上述烧杯中,…一直滴到溶液由红色刚刚变成无色为止;
第5步,记录实验数据;
第6步,计算,确定每毫升盐酸中含溶质HCl的质量.
请根据以上实验过程,回答下面问题:
①本实验为什么要用指示剂(酚酞)?
答:
②第3步中向量筒注入盐酸,量筒中液面的位置如图所示,A与B、B与C刻度间均相差1mL,如果刻度A为8,量筒中盐酸的体积是
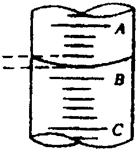
③第4步要用到玻璃棒,它是作
④第5步要记录的实验数据是
(3)测定每毫升该盐酸中含溶质HCl的质量,原理和方法还有多种,为此大家继续进行探究.有人提出用KOH等碱类试剂替代上述NaOH与盐酸进行中和反应,测定耗去盐酸的体积,通过计算确定盐酸中HCl的含量,这和上述实验属同一种方法.你能写出三种其它可行的方法吗?若能,请写在下面(用文字简述所依据的原理和要测定的数据,不需要写出化学方程式):
方法一:
方法二:
方法三:
(4)请你在上述三种方法中,选一种,并写出按此法实验所需要的玻璃仪器.
我选的是方法
查看习题详情和答案>>
(1)怎样立即确定它是不是浓盐酸?有人猜测是,有人记得好像不是,大家各抒己见.你认为,应该用下述中的
C
方法(填选项编号)立即确认.A.讨论 B.调查 C.实验 D.上网
具体的做法是
打开瓶塞,若有白雾冒出是浓盐酸,否则不是浓盐酸
.(2)粗略测定该盐酸每毫升溶液中含溶质HCl的质量.同学们依据酸和碱中和反应的原理,设计了一种可行的实验方案,其操作步骤如下:
第1步,在小烧杯中加入10g 5%的NaOH溶液;
第2步,向上述烧杯中滴入2滴酚酞试液;
第3步,向10mL的量筒里注入该盐酸至一定刻度;
第4步,用胶头滴管吸取量筒中的盐酸,逐滴滴入上述烧杯中,…一直滴到溶液由红色刚刚变成无色为止;
第5步,记录实验数据;
第6步,计算,确定每毫升盐酸中含溶质HCl的质量.
请根据以上实验过程,回答下面问题:
①本实验为什么要用指示剂(酚酞)?
答:
为了指示NaOH与HCl什么时候恰好完全中和
.②第3步中向量筒注入盐酸,量筒中液面的位置如图所示,A与B、B与C刻度间均相差1mL,如果刻度A为8,量筒中盐酸的体积是
7.2
mL.
③第4步要用到玻璃棒,它是作
搅拌
用,目的是使反应物混合均匀,充分反应
.停止滴入盐酸后,胶头滴管中残留的盐酸应全部滴回量筒中
.④第5步要记录的实验数据是
量筒中剩下盐酸的体积
.(3)测定每毫升该盐酸中含溶质HCl的质量,原理和方法还有多种,为此大家继续进行探究.有人提出用KOH等碱类试剂替代上述NaOH与盐酸进行中和反应,测定耗去盐酸的体积,通过计算确定盐酸中HCl的含量,这和上述实验属同一种方法.你能写出三种其它可行的方法吗?若能,请写在下面(用文字简述所依据的原理和要测定的数据,不需要写出化学方程式):
方法一:
用一定质量锌粒(或铁、镁等活泼金属)与盐酸反应,测量用去盐酸的体积
.方法二:
用一定质量CuO(或其他不溶性碱性氧化物)与盐酸反应,测量用去盐酸的体积
.方法三:
用一定质量CuO(或其他不溶性碱性氧化物)与盐酸反应,测量用去盐酸的体积
.(4)请你在上述三种方法中,选一种,并写出按此法实验所需要的玻璃仪器.
我选的是方法
①
,所需要的玻璃仪器是烧杯、量筒、胶头滴管、玻璃棒
.