网址:http://m.1010jiajiao.com/timu3_id_52447[举报]
为了验证“铁丝可以在纯净的氧气中燃烧”及“燃烧产物有中Fe2+、Fe3+的存在”。同学们将一根火柴棒塞入一段螺旋状普通细铁丝末端固定;用镊子将铁丝夹住,然后将火柴在酒精灯上点燃,将铁丝由集气瓶口向下慢慢深入,观察现象:
(1)甲同学只发现铁丝红热一下,然后没有现象了。请你分析铁丝没有燃烧的可能原因 (填序号):
A.氧气不纯(或没收集满)
B.火柴太长消耗了氧气
C.铁丝表面有氧化物(或铁锈)
D.没有预热末端铁丝,温度没有达到铁丝的着火点
(2)乙同学做了一些准备工作,当铁丝在纯净氧气中燃烧时,火星四射,并有黑色固体生成。现有实验用品:细纯铁铁丝、细含碳铁丝、镁条、细铜丝、集气瓶装的几瓶纯氧、火柴、酒精灯、镊子、砂纸等。请回答:
①你对“没有火焰”的现象,能提出的问题是: ;验证方法是: 。
②为了找出铁丝在纯氧中燃烧“火星四射”的原因,其假设和对应验证方法是:
。
③如果探究发现只有含碳细铁丝在纯氧中燃烧才出现“火星四射”现象,你分析其原因是: 。
(3)丙某同学为了验证“铁在氧气的燃烧产物中有Fe2+、Fe3+的存在”,设计并进行了如下实验:

试回答下列问题:
①试剂1是 ,试剂2是 。
②加入新制氯水后溶液中颜色加深是因为(用离子方程式表示)
。
③该同学猜想血红色溶液一段时间后变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗? 。若你认为不合理,请提出你的猜想 ,并设计一个简单的实验加以验证(若你认为合理,该空不要作答) 。
查看习题详情和答案>>(1)甲同学只发现铁丝红热一下,然后没有现象了。请你分析铁丝没有燃烧的可能原因 (填序号):
| A.氧气不纯(或没收集满) |
| B.火柴太长消耗了氧气 |
| C.铁丝表面有氧化物(或铁锈) |
| D.没有预热末端铁丝,温度没有达到铁丝的着火点 |
①你对“没有火焰”的现象,能提出的问题是: ;验证方法是: 。
②为了找出铁丝在纯氧中燃烧“火星四射”的原因,其假设和对应验证方法是:
。
③如果探究发现只有含碳细铁丝在纯氧中燃烧才出现“火星四射”现象,你分析其原因是: 。
(3)丙某同学为了验证“铁在氧气的燃烧产物中有Fe2+、Fe3+的存在”,设计并进行了如下实验:

试回答下列问题:
①试剂1是 ,试剂2是 。
②加入新制氯水后溶液中颜色加深是因为(用离子方程式表示)
。
③该同学猜想血红色溶液一段时间后变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗? 。若你认为不合理,请提出你的猜想 ,并设计一个简单的实验加以验证(若你认为合理,该空不要作答) 。
(1)检验这种新型洗涤剂中金属阳离子的操作和现象是
(2)这种洗涤剂中的双氧水可以将废水中的氰化物转化为无毒物同时生成NH3,写出反应的离子方程式
(3)如果配制洗涤剂的水中含有铁离子,不仅会削弱洗涤剂的去污能力,甚至完全失去杀菌作用.试分析其中的原因(用离子方程式和简要文字表述)
①
Fe3+与CO32-水解相互促进水解,使洗涤剂失去去污能力
Fe3+与CO32-水解相互促进水解,使洗涤剂失去去污能力
(4)某化学学习小组为了定性探究铁离子对这种新型洗涤剂的不良影响,取该洗涤剂100ml,加入25gFeCl3固体,产生大量无色无味气体,用贮气瓶收集气体.请选用下列试剂和实验用品完成气体成分的探究过程:0.10mol?L-1 NaOH、8.0mol?L-1 NaOH、澄清石灰水、0.01mol?L-1KMnO4、BaCl2稀溶液、品红溶液、蒸馏水、木条、酒精灯、火柴、洗气瓶.
①提出假设:对该气体成分提出合理假设.
假设1:气体是O2;
假设2:气体是
假设3:气体是CO2
②设计方案:设计实验方案证明你的假设,在答题卡上完成实验步骤、预期现象与结论:
| 实验步骤 | 预期现象与结论 |
| 将气体依次通入盛有澄清石灰水、 8.0mol?L-1 8.0mol?L-1 NaOH溶液 NaOH溶液 的洗气瓶中,并将带火星的木条放在最后一个洗气瓶的出口处 并将带火星的木条放在最后一个洗气瓶的出口处 . |
若澄清石灰水不变浑浊,木条复燃,则假设1成立; 若 澄清石灰水变浑浊,木条复燃 澄清石灰水变浑浊,木条复燃 ,则假设2成立;若澄清石灰水变浑浊,木条不复燃,则假设3成立. |
钨是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,有“光明使者”的美誉。钨在自然界主要以钨(+6价)酸盐的形式存在。有开采价值的钨矿石是白钨矿和黑钨矿。白钨矿的主要成分是钨酸钙(CaWO4);黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成(Fe.Mn)WO4。黑钨矿传统冶炼工艺的第一阶段是碱熔法:

其中A、B、C都是钨的化合物。回答:
(1)碱熔时,钨酸亚铁转化为氧化铁和钨酸钠,写出相应反应的化学方程式____。
(2)操作2的名称是 ,实验室中证明沉淀B是否洗净的方法是 ;实验室中焙烧需要的主要仪器有____;
(3)写出用氢气还原氧化钨制取金属钨的化学方程式; ;为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂,因为____。
(4)某种蓝色氧化钨的化学式可以表示为WO2.8,一般认为,蓝色氧化钨的颜色和非整比暗示了在化合物中存在五价和六价两种价态的钨。则蓝色氧化钨中这五价钨与六价钨的原子数目之比为 :_ ___。
查看习题详情和答案>>
钨是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,有“光明使者”的美誉。钨在自然界主要以钨(+6价)酸盐的形式存在。有开采价值的钨矿石是白钨矿和黑钨矿。白钨矿的主要成分是钨酸钙(CaWO4);黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成(Fe.Mn)WO4。黑钨矿传统冶炼工艺的第一阶段是碱熔法: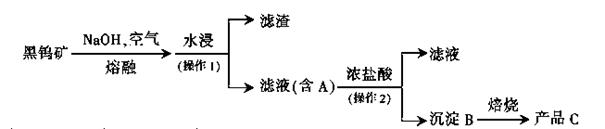
其中A、B、C都是钨的化合物。回答:
(1)碱熔时,钨酸亚铁转化为氧化铁和钨酸钠,写出相应反应的化学方程式____。
(2)操作2的名称是 ,实验室中证明沉淀B是否洗净的方法是 ;实验室中焙烧需要的主要仪器有____;
(3)写出用氢气还原氧化钨制取金属钨的化学方程式; ;为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂,因为____。
(4)某种蓝色氧化钨的化学式可以表示为WO2.8,一般认为,蓝色氧化钨的颜色和非整比暗示了在化合物中存在五价和六价两种价态的钨。则蓝色氧化钨中这五价钨与六价钨的原子数目之比为 :_ ___。