网址:http://m.1010jiajiao.com/timu3_id_5188[举报]
资料一:腾空而起人类要在月球表面下沉生活居住,首先离不开淡水和氧气,而月球上既没有水又没有空气。科学家发现月球的沙土中含有丰富的含氧钛铁矿,将这些矿石加热或通电,就可以从中分离出氧气。分离出的氧气可以用来呼吸或是作为火箭的助燃剂。人们还可以用氢气将含氧钛铁矿还原,同时得到淡水,再通电使水分解,又得到氧气和氢气。最初用作还原剂的氢气可以从地球上运来,生产开始后电解水获得的氢气即可循环使用。据估计,190t月球沙土含有15-16t含氧钛铁矿物,可制得1t氧气,而1t氧气便可维持10人在月球上生存一年的需要。
资料一:“嫦娥一号”卫星需要在太空环境下长时间停留,对材料的性能要求很高。卫星空间桁架是卫星发动机的支撑装置,要求材料轻、质量可靠、稳定性能好。天线采用碳复合材料制作支撑部件,定向天线展开臂比铝合金轻30%,在高低温交变的情况下,尺寸的稳定性远远优于金属。卫星的结构部件“长三甲”火箭的推进器、整流罩、火箭筒体、连接环等部件都使用了大量的铝镁合金材料。
设计问题:
1、月球土壤中存在天然的铁、金、银、铅等多种金属矿物颗粒。若从铁、金、银、铅混合金属中回收某些金属,将混合金属放入足量的盐酸中充分反应,然后过滤,剩余的固体不应该有的金属是[ ]
A、Ag、Au B、Au、Fe C、Pb、Ag D、Fe、Pb
2、“嫦娥一号”探月卫星采用碳复合材料替代铝合金制作定向天线展开臂,有较多优点,同时也是保护金属资源的一种措施,下列属于该措施的是[ ]
A、防止金属腐蚀 B、回收利用废旧金属
C、合理有效地开采矿物 D、寻找金属代用品
3、从铁生锈条件来分析,月球上铁制品 (填“易”或“不易”)生锈,原因是:
;针对上述原因分析,可以采取 等方法防止铁制品生锈。
4、科学家发现月球的沙土中含有丰富的含氧钛铁矿,若成分为TiO2、Fe2O3的混合物,现用CO进行还原提炼单质钛和铁,实验装置如图所示。按下列要求进行回答:

(1)写出有标号的仪器名称:
① ;② 。
(2)B装置中观察到的现象是 。
(3)写出A、B两部分所发生反应化学方程式:
A: 、 。
B: 。
(4)装置C的作用是 。
(5)用CO还原钛铁矿,生成钛和铁的混合物,主用简单的方法将两种物质分开 。
查看习题详情和答案>>A—I为初中化学中常见的物质。已知A为金属氧化物,C为大理石的主要成分,D为蓝色沉淀,G、I均为只含有一种溶质的溶液。“→”表示物质间存在着相互转化的关系(部分生成物未标出),如下图所示。请回答下列问题:

(1)写出化学式:A ,D 。
(2)写出B与I反应的化学方程式: 。
(3)已知H为一定量锌粉和铁粉的混合物,与溶液G充分反应后过滤。向滤渣E中加入稀盐酸,有无色气体放出,则滤渣E中一定含有 ,滤液F中一定含有的金属阳离子是 。
【解析】(1)C为大理石的主要成分,所以C为碳酸钙,根据B与I反应能生成碳酸钙和氢氧化钠,是B与I交换成分生成的碳酸钙和氢氧化钠,所以将碳酸钙和氢氧化钠相互交换成分为:碳酸钠和氢氧化钙,属于B与I两种物质中的成分,A为金属氧化物,A与水反应生成B,所以B是碱溶液,即氢氧化钙,所以A是氧化钙;I是碳酸钠,D为蓝色沉淀是氢氧化铜;
(2)B与I反应的反应物是氢氧化钙和碳酸钠,生成物是碳酸钙沉淀和氢氧化钠,用观察法配平,碳酸钙后面标上沉淀符号;
(3)由于G和氢氧化钠反应生成氢氧化铜沉淀,所以G为铜盐,锌粉和铁粉加入铜盐中发生了三个反应:锌与铜盐反应生成铜和锌盐,铁和铜盐反应生成亚铁盐和铜,锌与亚铁盐反应生成铁和锌盐;向滤渣E中加入稀盐酸,有无色气体放出,说明有排在氢前面的金属剩余,即铁或锌,如果锌有剩余,锌会把溶液中的铜、铁都置换出来,所以这时滤渣成分是锌、铁、铜,如果是铁,则铁会把排在它后面的铜全部置换出来,这时滤渣成分是铁、铜;所以这两种情况中一定存在的是铁和铜;如果锌有剩余时溶液中的亚铁离子、铜离子都会被置换出来,所以溶液F中一定存在的金属阳离子是锌离子
查看习题详情和答案>>
[查阅资料]
资料一:Fe粉和Fe3O4粉末能被磁铁吸引而FeO(黑色)不能;
资料二:Fe3O4中铁元素有+2、+3两种化合价,其化学式可用FeO?Fe2O3 的形式表示;
[提出猜想]黑色物质可能是Fe3O4、FeO和Fe粉中的一种或几种.
[进行实验]兴趣小组收集了CO与Fe2O3反应生成的黑色物质进行了下列实验:
| 实验方案 | 实验现象 | |
| 甲 | 取少量黑色物质用磁铁吸引 | 黑色物质全部被磁铁吸引 |
| 乙 | 取少量黑色物质加入30%热的盐酸中 | 无气泡、溶液颜色变成黄绿色 |
| 丙 | 取少量黑色物质加入硫酸铜溶液中 | 无任何现象 |
(1)甲实验现象说明黑色物质中没有
(2)生成的黑色物质应为Fe3O4;
(3)写出黑色粉末和热的盐酸反应的化学方程式
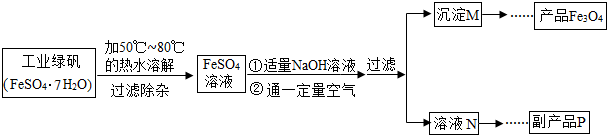
[拓展探究]同学们对Fe3O4产生了兴趣,从参考资料中找到了氧化沉淀法生产复印用高档Fe3O4粉的工艺流程简图.
[生产流程]
[查阅资料]
资料一:硫酸亚铁在不同温度下的溶解度如表所示:
| 温度/℃ | 0 | 10 | 30 | 50 | 60 | 70 | 80 | 90 |
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.3 | 33.0 | 30.5 | 27.0 |
资料三:获得Fe3O4的反应原理为:Fe(OH)2+2Fe(OH)3
| ||
[问题讨论]
(1)溶解时,用50℃至80℃的热水目的是
(2)写出加入适量NaOH溶液时发生反应的化学方程式
(3)上述过程中,要控制“通一定量空气”的目的是
(4)要使四氧化三铁的产率最高,则上述流程中产生的Fe(OH)2和Fe(OH)3的最佳质量比为
(5)副产品P是硫酸钠,由溶液N获得该副产品的操作顺序是b→
a.过滤 b.加热浓缩 c.冷却结晶 d.晶体加热至完全失去结晶水
[组成确定]为确定用以上方法制得的四氧化三铁中可能含有的杂质,同学们又进行了下列实验探究.
[查阅资料]
资料一:难溶性碱受热时能分解产生金属氧化物和水(反应中各种元素的化合价不变);
资料二:Fe2O3和CO反应是随温度升高而逐步进行的,先生成Fe3O4,再生成FeO(黑色),最后生成Fe;
[提出猜想]Fe3O4中可能含有的杂质是Fe2O3和FeO中的一种或两种.
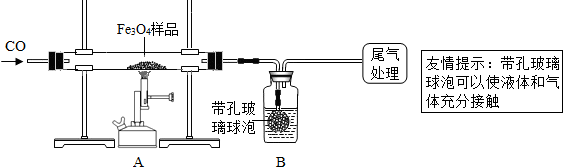
[实验设计]同学们称取了23.28g该Fe3O4样品进行了下列实验:
[实验分析]因探究思路不同,兴趣小组分成甲、乙两小组.
甲组:
(1)该组同学欲通过B装置反应前后的质量变化来计算确认该Fe3O4样品中的杂质.
B中的最佳试剂是
①澄清石灰水 ②氢氧化钠浓溶液 ③稀盐酸 ④水
(2)上述实验过程中,CO气体除作为反应物外,能起到的作用是:
①实验开始时,排尽装置中的空气,防止
②停止加热后,继续通CO气体,防止
在本实验中,CO气体还能起到的作用是③
(3)尾气如何处理?
乙组:
利用仪器测定并绘制成反应过程中A装置中玻璃管内的固体质量随温度的变化曲线(如图)
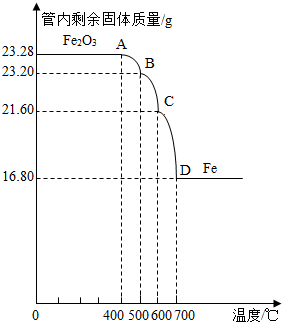
(1)写出BC段发生反应的化学方程式:
| ||
| ||
(2)通过分析计算确定:该Fe3O4样品中含有的杂质是