摘要:化学性质 (1)氧化反应 [演示实验5-4]将原先的装置中用于收集乙烯的导气管换成带玻璃尖嘴的导气管.点燃酒精灯.使反应温度迅速升至170℃.排空气.先收集一部分乙烯于试管中验纯.之后用火柴点燃纯净的乙烯. 实验现象:乙烯气体燃烧时火焰明亮.并伴有黑烟. [演示实验5-5]熄灭燃烧的乙烯气.冷却.将乙烯通入盛有酸性KMnO4溶液的试管中. 酸性KMnO4溶液的紫色很快褪去. [演示实验5-6]将乙烯气通入盛有溴的四氯化碳溶液的试管中. 实验现象:溴的四氯化碳溶液的红棕色很快褪去. (先撤出导管.后熄灭酒精灯.停止反应.演示实验结束) a.燃烧 CH2==CH2+3O22CO2+2H2O b.使酸性KMnO4溶液褪色 乙烯与溴反应时.乙烯分子的双键中有一个键被打开.两个溴原子分别加在两个价键不饱和的碳原子上.生成了无色的物质:1.2-二溴乙烷. (2)加成反应 加成反应:有机物分子中双键两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应. 除了溴之外还可以与水.氢气.卤化氢.Cl2等在一定条件下发生加成反应.如工业制酒精的原理就是利用乙烯与H2O的加成反应而生成乙醇. 学生动手写:与水.氢气.卤化氢.Cl2等在一定条件下发生加成反应的化学方程式. 制备CH3CH2Cl时.选用乙烯和HCl作反应物好.还是选用乙烷与Cl2作反应物好? [答]用乙烯和HCl作反应物好.因为二者发生加成反应后无副产物.而乙烷与Cl2发生取代反应后产物有多种.副产物太多. 本节小结:本节课我们学习和讨论了乙烯的分子结构.探究了乙烯的实验室制法的制备原理.发生装置.收集方法等.并制备收集了乙烯气.实验验证了乙烯的重要化学性质.氧化反应和加成反应.并分析了乙烯的聚合反应的特点,了解了乙烯的重要用途和烯烃的相关知识.重点应掌握乙烯的实验室制法及相关问题和其主要的化学性质. ●板书设计 第三节 乙烯 烯烃 不饱和烃的概念
网址:http://m.1010jiajiao.com/timu3_id_51783[举报]
类比乙烯和乙醇的化学性质,推测丙烯醇(CH2=CH-CH2OH)可发生的化学反应有( )
①加成反应 ②氧化反应 ③燃烧 ④加聚反应 ⑤取代反应 ⑥与Na2CO3溶液反应放出CO2.
①加成反应 ②氧化反应 ③燃烧 ④加聚反应 ⑤取代反应 ⑥与Na2CO3溶液反应放出CO2.
| A、只有①②③⑥ | B、只有①②③④ | C、只有①③④⑥ | D、只有①②③④⑤ |
由本题所给的①、②两条信息,结合已学知识,回答下列问题.
①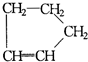 是环戊烯的结构简式,可进一步简写为
是环戊烯的结构简式,可进一步简写为 ,环烯烃的化学性质跟烯烃相似. ②有机化合物中的烯键可以跟臭氧(O3)反应,再在锌粉存在下水解即将原有的烯键断裂,断裂处两端的碳原子各结合1个氧原子而生成醛基(-CHO)或酮基(
,环烯烃的化学性质跟烯烃相似. ②有机化合物中的烯键可以跟臭氧(O3)反应,再在锌粉存在下水解即将原有的烯键断裂,断裂处两端的碳原子各结合1个氧原子而生成醛基(-CHO)或酮基( ),这两步反应合在一起,称为“烯键的臭氧分解”.例如:
),这两步反应合在一起,称为“烯键的臭氧分解”.例如:


(1)写出异戊二烯臭氧分解的各种产物的结构简式
(2)a mol某烃CnH2n-2(该分子中无-C≡C-)和 结构),发生臭氧分解后,测得有机产物中含有羰基(
结构),发生臭氧分解后,测得有机产物中含有羰基( )b mol,则a和b的代数关系是:
)b mol,则a和b的代数关系是:
(3)写出由环己醇( )和乙醇为有机原料,合成己二酸二乙酯的各步反应方程式
)和乙醇为有机原料,合成己二酸二乙酯的各步反应方程式
(4)某烃A的化学式为C10H16,A经臭氧分解可得到等物质的量的两种产物,其结构简式分别为HCHO和 .A经催化加氢后得产物B,B的化学式为C10H20,分析数据表明,B分子内含有六元碳环.试写出A和B的结构简式A
.A经催化加氢后得产物B,B的化学式为C10H20,分析数据表明,B分子内含有六元碳环.试写出A和B的结构简式A
 ,B
,B
 .
.
(5)从香精油中分离到一种化合物[A](C10H16),1mol[A]在催化加氢时可吸收2mol氢气;1mol[A]经臭氧氧化反应再加锌粉水解可得到1mol丙酮[(CH3)2C=O]和1mol3,6-二羰基庚醛 ,则推测得[A]的结构式为
,则推测得[A]的结构式为

 .
.
(6)一定量的化学式均为C4H8的不饱和烃的混合气体,经臭氧分解后生成8.7g酮、0.45mol的醛(其中甲醛有0.21mol).试通过计算回答下列问题:
(a)氧化后生成哪些物质?写出结构简式
(b)混合气体中含哪几种烃(写结构简式)?其物质的量之比为多少?
查看习题详情和答案>>
①
 是环戊烯的结构简式,可进一步简写为
是环戊烯的结构简式,可进一步简写为 ,环烯烃的化学性质跟烯烃相似. ②有机化合物中的烯键可以跟臭氧(O3)反应,再在锌粉存在下水解即将原有的烯键断裂,断裂处两端的碳原子各结合1个氧原子而生成醛基(-CHO)或酮基(
,环烯烃的化学性质跟烯烃相似. ②有机化合物中的烯键可以跟臭氧(O3)反应,再在锌粉存在下水解即将原有的烯键断裂,断裂处两端的碳原子各结合1个氧原子而生成醛基(-CHO)或酮基( ),这两步反应合在一起,称为“烯键的臭氧分解”.例如:
),这两步反应合在一起,称为“烯键的臭氧分解”.例如:

(1)写出异戊二烯臭氧分解的各种产物的结构简式
HCHO、

HCHO、
,它们的物质的量之比为
2:1
2:1
.(2)a mol某烃CnH2n-2(该分子中无-C≡C-)和
 结构),发生臭氧分解后,测得有机产物中含有羰基(
结构),发生臭氧分解后,测得有机产物中含有羰基( )b mol,则a和b的代数关系是:
)b mol,则a和b的代数关系是:b=4a
b=4a
或b=2a
b=2a
.(3)写出由环己醇(
 )和乙醇为有机原料,合成己二酸二乙酯的各步反应方程式
)和乙醇为有机原料,合成己二酸二乙酯的各步反应方程式① 、
、
② 、
、
③ 、
、
④
 、
、②
 、
、③
 、
、④

① 、
、
② 、
、
③ 、
、
④
. 、
、②
 、
、③
 、
、④

(4)某烃A的化学式为C10H16,A经臭氧分解可得到等物质的量的两种产物,其结构简式分别为HCHO和
 .A经催化加氢后得产物B,B的化学式为C10H20,分析数据表明,B分子内含有六元碳环.试写出A和B的结构简式A
.A经催化加氢后得产物B,B的化学式为C10H20,分析数据表明,B分子内含有六元碳环.试写出A和B的结构简式A



(5)从香精油中分离到一种化合物[A](C10H16),1mol[A]在催化加氢时可吸收2mol氢气;1mol[A]经臭氧氧化反应再加锌粉水解可得到1mol丙酮[(CH3)2C=O]和1mol3,6-二羰基庚醛
 ,则推测得[A]的结构式为
,则推测得[A]的结构式为 

(6)一定量的化学式均为C4H8的不饱和烃的混合气体,经臭氧分解后生成8.7g酮、0.45mol的醛(其中甲醛有0.21mol).试通过计算回答下列问题:
(a)氧化后生成哪些物质?写出结构简式
CH3CH2CHO、CH3CHO、HCHO、(CH3)2CO
CH3CH2CHO、CH3CHO、HCHO、(CH3)2CO
.(b)混合气体中含哪几种烃(写结构简式)?其物质的量之比为多少?
(CH3)2C=CH2、CH3CH2CH=CH2、CH3CH=CHCH3
(CH3)2C=CH2、CH3CH2CH=CH2、CH3CH=CHCH3
,5:2:3
5:2:3
.已知有机物A、B、C、D、E、F之间的转化关系如图所示,世界上已将B的产量作为衡量一个国家石油化工发展水平的重要标志.D是常用做汽车发动机的抗冻剂,E为聚合物,F的式量为26.
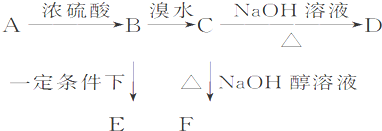
根据信息回答下列问题:
(1)B转化为C的反应类型 .
(2)有机物C具有以下哪几方面的化学性质 (填序号).
①加成反应 ②取代反应 ③消去反应 ④催化氧化反应 ⑤还原反应
(3)E的结构简式为 .
(4)C→F反应的方程式 .
查看习题详情和答案>>
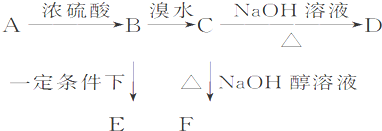
根据信息回答下列问题:
(1)B转化为C的反应类型
(2)有机物C具有以下哪几方面的化学性质
①加成反应 ②取代反应 ③消去反应 ④催化氧化反应 ⑤还原反应
(3)E的结构简式为
(4)C→F反应的方程式
(2012?和平区一模)已知:(I)B的产量可以用来衡量-个国家的石油化工发展水平.

有机物A是一种香料化合物,其化学性质稳定,香气柔和清雅,具有新鲜苹果和草莓的香气,广泛用于花香型和果香型香精的调配.其合成过程如下:
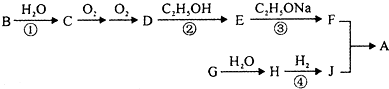
(1)J的相对分子质量为76,不能与NaHCO3溶液反应,1mol J能与足量的Na反应生成1mol H2,J的一氯代物有两种,写出J的结构简式
(2)有机物G中含有一种与B相同的官能团,还能与新制的Cu(OH)2生成红色沉淀,G中的含氧官能团的名称为
(3)写出②的化学反应方程式
(4)反应①、②、④中属于取代反应的是
(5)关于H下列说法正确的是.
a.含有两种不同的官能团
b.能发生银镜反应,与H互为同分异构体的有机物还有一种
c.H可以发生加成反应,消去反应,氧化反应和还原反应
d.H具有弱酸性
(6)E有多种同分异构体.能发生水解反应且能发生银镜反应的同分异构体有
(7)写出制备A的化学方程式:
 .
.
查看习题详情和答案>>

有机物A是一种香料化合物,其化学性质稳定,香气柔和清雅,具有新鲜苹果和草莓的香气,广泛用于花香型和果香型香精的调配.其合成过程如下:

(1)J的相对分子质量为76,不能与NaHCO3溶液反应,1mol J能与足量的Na反应生成1mol H2,J的一氯代物有两种,写出J的结构简式
CH2OHCH2CH2OH
CH2OHCH2CH2OH
.(2)有机物G中含有一种与B相同的官能团,还能与新制的Cu(OH)2生成红色沉淀,G中的含氧官能团的名称为
醛基
醛基
.(3)写出②的化学反应方程式
CH3COOH+C2H5OH
CH3COOC2H5+H2O
| 浓硫酸 |
| △ |
CH3COOH+C2H5OH
CH3COOC2H5+H2O
.| 浓硫酸 |
| △ |
(4)反应①、②、④中属于取代反应的是
②
②
.(5)关于H下列说法正确的是.
a.含有两种不同的官能团
b.能发生银镜反应,与H互为同分异构体的有机物还有一种
c.H可以发生加成反应,消去反应,氧化反应和还原反应
d.H具有弱酸性
(6)E有多种同分异构体.能发生水解反应且能发生银镜反应的同分异构体有
2
2
种,写出其中一种核磁共振氢谱有四个峰,且峰面积之比为1:2:2:3的同分异构体的结构简式HCOOCH2CH2CH3
HCOOCH2CH2CH3
.(7)写出制备A的化学方程式:


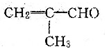 的化学性质叙述错误的是( )
的化学性质叙述错误的是( )