摘要:已知金刚砂SiC是原子晶体.则①金刚石②晶体硅③SiC.三者的熔沸点高低顺序正确的是 A.①>③>② B.③>②>① C.②>①>③ D.③>①>②
网址:http://m.1010jiajiao.com/timu3_id_51345[举报]
 (2013?青岛一模)[化学-物质结构与性质]
(2013?青岛一模)[化学-物质结构与性质]太阳能电池的发展已经进入了第三代.第三代就是铜铟镓硒CIGS等化合物薄膜太阳能电池以及薄膜Si系太阳能电池.完成下列填空:
(1)亚铜离子(Cu+)基态时的电子排布式为
[Ar]3d10
[Ar]3d10
;(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为
Br>As>Se
Br>As>Se
(用元素符号表示),用原子结构观点加以解释As、Se、Br原子半径依次减小,原子核对外层电子的吸引力依次增强,元素的第一电离能依次增大;Se原子最外层电子排布为4s24p4,而As原子最外层电子排布为4s24p3,p电子排布处于半充满状态,根据洪特规则特例可知,半充满状态更稳定,所以As元素的第一电离能比Se大
As、Se、Br原子半径依次减小,原子核对外层电子的吸引力依次增强,元素的第一电离能依次增大;Se原子最外层电子排布为4s24p4,而As原子最外层电子排布为4s24p3,p电子排布处于半充满状态,根据洪特规则特例可知,半充满状态更稳定,所以As元素的第一电离能比Se大
;(3)与镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成加合物,如BF3能与NH3反应生成BF3?NH3. BF3?NH3中B原子的杂化轨道类型为
sp3
sp3
,B与N之间形成配位
配位
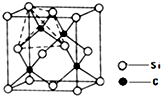
键;(4)单晶硅的结构与金刚石结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子不成键,则得如图所示的金刚砂(SiC)结构;在SiC中,每个C原子周围最近的C原子数目为
12
12
.