摘要:酸碱指示剂 (1)酸碱指示剂的变色范围 甲基 3.1< 3.1~4.4 >4.4 红 橙 黄 酚酞 5< 8~10 >10 无色 浅红 红 石蕊 8< 5~8 >8 红 紫 蓝 (2)根据滴定曲线和指示剂的发色范围选用指示剂. 从上面滴定曲线图可依次看出 ①0.1mol/L NaOH 滴定盐酸.酚酞和甲基均可使用.当然两者测定结果不同. ②0.1mol/L NaOH溶液滴定0.1mol/L CH3COOH溶液 恰好中和生成CH3COOCa,溶液呈弱碱性,选酚酞为指示剂,PH=8~10浅红色,误差小. ③用HCl滴定NH3.H2O 恰好中和生成NH4Cl,溶液呈弱酸性,选甲基橙为指示剂,3.1~4.4橙色.误差小. ④用HCl滴定0.1mol/L Na2CO3溶液 第一步生成N aHCO3时.可选用酚酞为指示剂.由红色→浅红→无色.化学方程式为: Na2CO3+HCl===NaHCO3+NaOH 第二步生成碳酸(CO2↑+H2O).可选用甲基橙为指示剂.由黄色→橙色.化学方程式为:NaHCO3+HCl===NaCl+H2O+CO2↑ 小 结: (1)指示剂的选择: ①强酸强碱相互滴定.可选用甲基橙或酚酞. ②若反应生成强酸弱碱盐溶液呈酸性.则选用酸性变色范围的指示剂,若反应生成强碱弱酸盐.溶液呈碱性.则选用碱性变色范围的指示剂 ③石蕊试液因颜色变化不明显.且变色范围过宽.一般不作滴定指示剂. (2)终点判断:(滴入最后一滴.溶液变色后.半分钟内不复原) 指示剂 操 作 酚酞 甲基橙 强碱滴定强酸 无色变为浅红色 橙色变为黄色 强酸滴定强碱 浅红色变为无色 黄色变为橙色
网址:http://m.1010jiajiao.com/timu3_id_51032[举报]
以下是几种酸碱指示剂的变色范围:
①甲基橙3.1~4.4,
②甲基红4.4~6.2,
③酚酞8.2~10.
现用0.1000 mol·L-1 NaOH溶液滴定浓度相近的甲酸时,上述指示剂
- A.都可以用
- B.只能用③
- C.可以用①或②
- D.可以用②或③
中性红指示剂的变色范围:pH为6.8~8.0,酸色为红色,碱色为黄色。如图所示为电解MgSO4稀溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色。下列说法正确的是
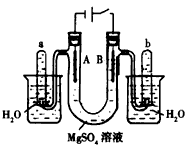
[ ]
A.若B电极为Cu电极时,将电解一段时间后的溶液倒入烧杯中充分振荡后,溶液呈红色
B.若两电极均为铂电极时,电解一段时间后,电极A附近溶液不变色
C.工业上可以用真空碳热还原氧化镁制取金属镁
D.若两电极均为铂电极时,电解一段时间后,电极B附近溶液由红色变成黄色
查看习题详情和答案>>
B.若两电极均为铂电极时,电解一段时间后,电极A附近溶液不变色
C.工业上可以用真空碳热还原氧化镁制取金属镁
D.若两电极均为铂电极时,电解一段时间后,电极B附近溶液由红色变成黄色
|
以下是几种酸碱指示剂的变色范围:①甲基橙3.1~4.4,②甲基红4.4~6.2,③酚酞8.2~10.现用0.1000 mol·L-1 NaOH溶液滴定浓度相近的甲酸时,上述指示剂 | |
| [ ] | |
A. |
都可以用 |
B. |
只能用③ |
C. |
可以用①或② |
D. |
可以用②或③ |