摘要:Fe2+和Fe3+的颜色 Fe2+在水溶液中通常以水合离子[Fe(H2O)6]2+形式存在.呈淡绿色.并存在下列平衡: [Fe(H2O)6]2++H2O[Fe(H2O)5OH]++H2O+ 这个平衡的pK=9.5.水解的程度很小.溶液近于中性. Fe3+在酸性溶液中.通常以淡紫色的[Fe(H2O)6]3+形式存在.三氯化铁以及其他+3价铁盐溶于水后都发生显著的水解.实质是+3价水合铁离子的水解.只有在PH=0左右时.才有[Fe(H2O)6]3+存在(但由于有阴离子的存在.会生成其他的络离子.影响淡紫色的观察).当PH为2-3时.水解趋势很明显.它们的水解平衡如下: [Fe(H2O)6]3++H2O[Fe(H2O)5(OH)]2++H3O+ K=10-3.05 [Fe(H2O)5(OH)]2++H2O[Fe(H2O)4(OH)2]++H3O+ K=10-3.26 生成的碱式离子呈黄色.它可聚合成二聚体: 2[Fe(H2O)6]3+ [Fe2(H2O)8(OH) 2]4++2H3O+ K=10-2.91 二聚体是借OH-为桥把2个Fe3+连结起来形成的多核络离子.溶液的PH越高.水解聚合的倾向越大.最后逐渐形成胶体.析出红综色水合氧化铁沉淀.
网址:http://m.1010jiajiao.com/timu3_id_50967[举报]
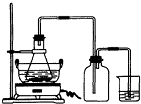 (2009?广东模拟)绿矾(FeSO4?7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.请回答下列问题:
(2009?广东模拟)绿矾(FeSO4?7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.请回答下列问题:(1)右图锥形瓶中的反应物是铁屑和28%的硫酸,反应前常用98%的硫酸配制500g 28%的硫酸,要算出所需98%的硫酸的体积,还要知道的数据是
98%硫酸的密度
98%硫酸的密度
.(2)在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe2+被氧化.设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤同,制得硫酸亚铁,并对产品质量进行检测.检测结果如下:
| 序号 | 反应物用量 | 产品质量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于Ⅰ级~Ⅱ级之间 |
| 2 | n(H2SO4):n(Fe)<1:1 | 优于Ⅰ级 |
铁
铁
过量为最佳.(3)该小组在继续研究由绿矾制备Fe(OH)2的过程中,发现出现白色的沉淀会逐渐转变为灰绿色,最后变为红褐色.甲同学查资料该灰绿色沉淀可能是Fe3(OH)8,请用氧化物的形式写出该沉淀
FeO?Fe2O3?4H2O
FeO?Fe2O3?4H2O
;乙同学查资料后认为该灰绿色沉淀是由于Fe(OH)2部分被氧化,混入少量的Fe(OH)3的缘故,请提出一种在研究由Fe2+制备Fe(OH)2的过程中,有助于对沉淀由“白”变“绿”的现象进行合理解释的实验设计新思路向Fe2+和Fe3+的混合液中加入NaOH溶液后,观察生成的沉淀的颜色是否为灰绿色.或者可以将Fe(OH)3和Fe(OH)2混合后观察其颜色
向Fe2+和Fe3+的混合液中加入NaOH溶液后,观察生成的沉淀的颜色是否为灰绿色.或者可以将Fe(OH)3和Fe(OH)2混合后观察其颜色
. 某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:
某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:[实验设计]
方法一:按照图1进行实验,容器A中的反应开始时,弹簧夹C处于打开状态,一段时间后,关闭弹簧夹C,容器A中的反应仍在进行.最终在
B
B
容器中观察到白色沉淀,该实验中涉及到的化学方程式有:Fe+H2SO4=FeSO4+H2↑、FeSO4+2NaOH=Fe(OH)2↓+Na2SO4、H2SO4+2NaOH=Na2SO4+2H2O
Fe+H2SO4=FeSO4+H2↑、FeSO4+2NaOH=Fe(OH)2↓+Na2SO4、H2SO4+2NaOH=Na2SO4+2H2O
.方法二:按图2进行实验,最终在两极间的溶液中首先观察到白色沉淀.请从所提供的试剂或电极材料中选择正确的序号填在横线上:
①纯水 ②NaCl溶液 ③NaOH溶液 ④四氯化碳 ⑤CuCl2溶液 ⑥乙醇 ⑦Fe棒 ⑧植物油 ⑨碳棒
a为
⑦
⑦
,b为⑨或⑦
⑨或⑦
,c为⑧
⑧
,d为②或③
②或③
.(填序号)[探究思考]实验表明上述实验中出现白色的沉淀会逐渐转变为灰绿色或绿色,那么如何解释出现灰绿色或绿色的现象呢?
(1)甲同学查阅资料后,得到Fe(OH)2如下信息:
| 资料名称 | 物理性质描述 | 化学性质描述 |
| 《化学辞典》,顾翼东编,1989年版P637 | 白色无定形粉末或白色至淡绿色六方晶体 | 与空气接触易被氧化,将细粉喷于空气中,则立即燃烧出火花 |
| 《大学普通化学(下册)》傅鹰著P637 | 白色沉淀 | 此沉淀易被氧化成微绿色Fe3(OH)8 |
| 《普通化学教程》(下册)P788 | 白色 | 能强烈吸收O2,迅速变成棕色Fe(OH)3.这时作为氧化的中间产物为土绿色,其中含有Fe2+、Fe3+. |
由于Fe(OH)2部分被氧化,混入少量的Fe(OH)3
由于Fe(OH)2部分被氧化,混入少量的Fe(OH)3
;资料中提及的微绿色Fe3(OH)8,用氧化物的形式表示可写成FeO?Fe2O3?4H2O
FeO?Fe2O3?4H2O
.(2)乙同学依据配色原理:白色和棕色不可能调配成绿色或灰绿色的常识,认为绿色可能是形成Fe(OH)2?nH2O所致.用热水浴的方式加热“方法一”中生成的绿色沉淀,观察到沉淀由绿变白的趋势.
加热时,“方法一”中弹簧夹C应处于
打开
打开
(填“打开”或“关闭”)状态,容器A中的反应须处于发生
发生
(填“停止”或“发生”)状态.写出该实验中支持乙同学观点的化学方程式Fe(OH)2?nH2O
Fe(OH)2+nH2O
| ||
Fe(OH)2?nH2O
Fe(OH)2+nH2O
.
| ||
(3)欢迎你参加该研究小组的讨论,请提出一种在研究由Fe2+制备Fe(OH)2的过程中,有助于对沉淀由“白”变“绿”的现象进行合理解释的实验设计新思路.
向Fe2+和Fe3+的混合液中加入NaOH溶液后,观察生成的沉淀的颜色是否为灰绿色(或者可以将Fe(OH)3和Fe(OH)2混合后观察其颜色
向Fe2+和Fe3+的混合液中加入NaOH溶液后,观察生成的沉淀的颜色是否为灰绿色(或者可以将Fe(OH)3和Fe(OH)2混合后观察其颜色
.阅读下列材料后回答问题:
一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+ 和Fe3+的形式存在.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁.服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收.
(1)在人体中进行Fe2+
Fe3+的转化时,Fe3+作
(2)“服用维生素C,可使食物中的Fe3+还原成Fe2+”这句话指出,维生素C在这一反应中作
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐.此反应的化学方程式为
(4)某食堂为学生准备的一次晚饭食谱为:馒头、牛奶、鸡蛋、米汤、炒辣椒、醋泡咸盐豆.其中富含维生素C的食物为
(5)小芳同学在这次晚饭中食用了2g 加碘(KIO3)食盐,计算她这次晚餐中补充的碘元素质量(mg).
(设每千克加碘食盐中含KIO340mg,计算结果保留两位小数)
查看习题详情和答案>>
一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+ 和Fe3+的形式存在.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁.服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收.
(1)在人体中进行Fe2+
| 常温 |
氧化剂
氧化剂
剂(填“氧化剂”或“还原剂”);(2)“服用维生素C,可使食物中的Fe3+还原成Fe2+”这句话指出,维生素C在这一反应中作
还原
还原
剂;(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐.此反应的化学方程式为
Fe+2HCl=FeCl2+H2↑
Fe+2HCl=FeCl2+H2↑
;(4)某食堂为学生准备的一次晚饭食谱为:馒头、牛奶、鸡蛋、米汤、炒辣椒、醋泡咸盐豆.其中富含维生素C的食物为
辣椒
辣椒
,食醋中常用的防腐剂为苯甲酸
苯甲酸
,小华同学为了证明该食堂所提供的牛奶中没有添加米汤,他应该做的实验以及观察到的现象为取少量牛奶,向其中加入碘水,不变为蓝色
取少量牛奶,向其中加入碘水,不变为蓝色
;(5)小芳同学在这次晚饭中食用了2g 加碘(KIO3)食盐,计算她这次晚餐中补充的碘元素质量(mg).
(设每千克加碘食盐中含KIO340mg,计算结果保留两位小数)
(1)在氧化还原反应中,氧化剂
(2)正常人体内铁元素以Fe2+和Fe3+的形式存在.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁.服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收.则,在人体中进行①Fe2+→Fe3+的转化时,Fe2+作
②Fe3+→Fe2+的转化时,Fe3+作
查看习题详情和答案>>
得到
得到
电子,发生的反应是还原
还原
反应;还原剂失去
失去
电子,发生的反应是氧化
氧化
反应.铁与氯气反应的方程式为2Fe+3Cl2=2FeCl3,生成物中铁是+3
+3
价,当1mol铁反应时,反应中转移的电子3
3
mol;铁与盐酸的离子反应方程式为Fe+2H+=Fe2++H2↑
Fe+2H+=Fe2++H2↑
.(2)正常人体内铁元素以Fe2+和Fe3+的形式存在.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁.服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收.则,在人体中进行①Fe2+→Fe3+的转化时,Fe2+作
还原
还原
剂,发生氧化
氧化
反应.②Fe3+→Fe2+的转化时,Fe3+作
氧化
氧化
剂,发生还原
还原
反应.