网址:http://m.1010jiajiao.com/timu3_id_50944[举报]
工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]已去除表面氧化物的铁钉(碳素钢)放入浓硫酸中,加热,充分反应后收集到气体Y。某同学认为气体Y中除了SO2外还可能含有H2和CO2气体,为此设计了下列实验装置,探究Y中H2和CO2的存在(图中夹持仪器省略)。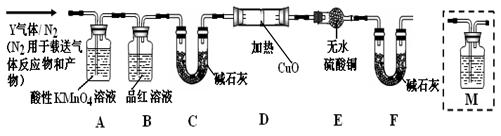
(1)装置B中试剂的作用是 。
(2)认为气体Y中还含有CO2的理由是 (用化学方程式表示)。
(3)为确认CO2的存在,需在装置中添加M于 (选填序号)。
a.. A之前 b . A-B间 c . B-C间 d . C-D间
(4)如果气体Y中含有H2,预计实验现象应是 。
[探究二] SO2气体还原Fe3+、I2,使用的药品和装置如下图所示: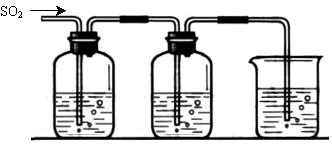
FeCl3溶液 含有淀粉的碘水 NaOH溶液
A B C
(5)装置C的作用是 。
(6)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发浓缩、冷却结晶、 、洗涤、自然干燥,在这一系列操作中没有用到的仪器有 (填序号)。
| A.蒸发皿 | B.石棉网 | C.漏斗 | D.烧杯 E.玻璃棒 F. 坩埚 |
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是 原因是 (8)能表明I-的还原性弱于SO2的现象是 。 查看习题详情和答案>>
工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]已去除表面氧化物的铁钉(碳素钢)放入浓硫酸中,加热,充分反应后收集到气体Y。某同学认为气体Y中除了SO2外还可能含有H2和CO2气体,为此设计了下列实验装置,探究Y中H2和CO2的存在(图中夹持仪器省略)。

(1)装置B中试剂的作用是 。
(2)认为气体Y中还含有CO2的理由是 (用化学方程式表示)。
(3)为确认CO2的存在,需在装置中添加M于 (选填序号)。
a.. A之前 b . A-B间 c . B-C间 d . C-D间
(4)如果气体Y中含有H2,预计实验现象应是 。
[探究二] SO2气体还原Fe3+、I2,使用的药品和装置如下图所示: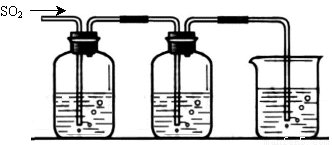
FeCl3溶液 含有淀粉的碘水 NaOH溶液
A B C
(5)装置C的作用是 。
(6)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发浓缩、冷却结晶、 、洗涤、自然干燥,在这一系列操作中没有用到的仪器有 (填序号)。
A.蒸发皿 B.石棉网 C.漏斗 D.烧杯 E.玻璃棒 F. 坩埚
(7)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是 原因是 (8)能表明I-的还原性弱于SO2的现象是 。
查看习题详情和答案>>
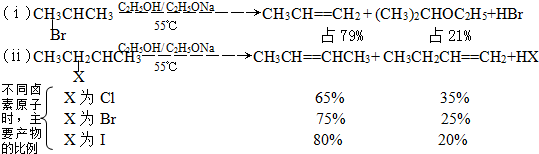
根据上面两个反应的条件及其数据,请写出你认为最具概括性的两条结论:
①
②
(2)由丙烯经下列反应可制得化工原料H及F、G两种高分子化合物(它们都是常用的塑料),其合成线路如下:
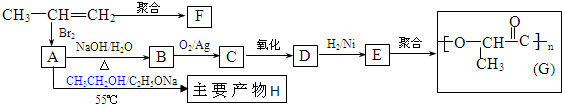
请完成下列填空:
①写出结构简式:聚合物F是
②B转化为C的化学方程式为:
③在一定条件下,两分子E能脱去两分子水形成一种元环状化合物,该化合物的结构简式是
复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaR |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是_______________________(填编号)。
A.CO2+H2O +2NaClO===Na2CO3+2HClO
B.CO2+H2O +NaClO===NaHCO3+HClO
C.CO2 +H2O +NaR![]() NaHCO3+HR
NaHCO3+HR
D.CO2 +H2O +2NaR![]() Na2CO3+2HR
Na2CO3+2HR
E.Na2CO3+HR![]() NaHCO3+NaR
NaHCO3+NaR
F.CH3COOH+NaCN===CH3COONa+HCN
(2)根据前述信息判断,浓度均为0.05 mol/L的下列六种物质的溶液中,pH最小的是______(填编号); 其pH为___________(填数值);pH最大的是_________(填编号)。
①HR ②CH3COOH ③HCN ④HClO ⑤H2SO4 ⑥HClO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
③蒸发KCl和NaNO3混合溶液,首先析出NaCl晶体
根据上述反应,总结出复分解反应发生的另一规律:______________________;
将KI溶液和AgCl固体混合搅拌,会观察到的现象是_______________________,
请写出反应的离子方程式:____________________________________________。
查看习题详情和答案>>复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaR |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是_______________________(填编号)。
A.CO2+H2O+2NaClO===Na2CO3+2HClO
B.CO2+H2O+NaClO===NaHCO3+HClO
C.CO2 +H2O+NaRNaHCO3+HR
D.CO2 +H2O+2NaRNa2CO3+2HR
E.Na2CO3+HRNaHCO3+NaR
F.CH3COOH+NaCN===CH3COONa+HCN
(2)根据前述信息判断,浓度均为0.05 mol/L的下列六种物质的溶液中,pH最小的是______(填编号); 其pH为___________(填数值);pH最大的是_________(填编号)。
①HR ②CH3COOH ③HCN ④HClO ⑤H2SO4 ⑥HClO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
③蒸发KCl和NaNO3混合溶液,首先析出NaCl晶体
根据上述反应,总结出复分解反应发生的另一规律:______________________;
将KI溶液和AgCl固体混合搅拌,会观察到的现象是_______________________,
请写出反应的离子方程式:____________________________________________。
查看习题详情和答案>>