摘要:电解法: 适用范围:活泼的金属 K----- Al 如: 2Al2O3 ==== 4Al + 3O2↑ 2NaCl===2Na +Cl2↑ 比较: 2NaCl+2H2O===2NaOH +H2↑+Cl2↑ 2CuSO4+2H2O===2Cu+2H2SO4+O2↑ 电解法也常用于某些不活泼的金属的精炼. [说明]电解法的缺点是要消耗大量的电能,成本较高.
网址:http://m.1010jiajiao.com/timu3_id_50929[举报]
(2012?和平区一模)铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准.
(1)含铬废水排放到河水中一定浓度会使鱼类等水生动物死亡的原因是
常用的处理方法有两种.
方法1:还原沉淀法
该法用FeSO4将以Cr2O72-的形式存在于酸性废水中的铬元素还原为Cr3+,再用沉淀法进行分离.已知:
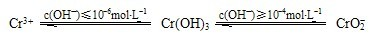
(2)FeSO4还原Cr2O72-的离子方程式为
(3)Cr2(SO4)3溶液中加入过量NaOH浓溶液,反应的离子方程式为
(4)沉淀法分离废水中的Cr3+离子,pH应控制在
(5)下列关于铬及其化合物的说法中正确的是
a.K2Cr2O7是-种常用的强氧化剂
b.NaCrO2溶液与AlCl3溶液混合有沉淀生成
c.酸性K2Cr2O7溶液可用于检验司机是否酒后驾车
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(6)用Fe做电极的原因为
(7)在阴极附近溶液pH升高的原因是(用电极反应解释)
查看习题详情和答案>>
(1)含铬废水排放到河水中一定浓度会使鱼类等水生动物死亡的原因是
重金属离子会使蛋白质变性
重金属离子会使蛋白质变性
.常用的处理方法有两种.
方法1:还原沉淀法
该法用FeSO4将以Cr2O72-的形式存在于酸性废水中的铬元素还原为Cr3+,再用沉淀法进行分离.已知:
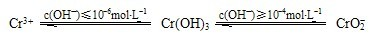
(2)FeSO4还原Cr2O72-的离子方程式为
Cr2O72-+6Fe2++14H+=3Cr3++6Fe3++7H2O
Cr2O72-+6Fe2++14H+=3Cr3++6Fe3++7H2O
.(3)Cr2(SO4)3溶液中加入过量NaOH浓溶液,反应的离子方程式为
Cr3++4OH-=CrO2-+2H2O
Cr3++4OH-=CrO2-+2H2O
.(4)沉淀法分离废水中的Cr3+离子,pH应控制在
8~10
8~10
范围内.(5)下列关于铬及其化合物的说法中正确的是
abc
abc
.a.K2Cr2O7是-种常用的强氧化剂
b.NaCrO2溶液与AlCl3溶液混合有沉淀生成
c.酸性K2Cr2O7溶液可用于检验司机是否酒后驾车
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(6)用Fe做电极的原因为
阳极反应为Fe-2e-=Fe2+,提供还原剂Fe2+
阳极反应为Fe-2e-=Fe2+,提供还原剂Fe2+
.(7)在阴极附近溶液pH升高的原因是(用电极反应解释)
2H++2e-=H2↑
2H++2e-=H2↑
.溶液中同时生成的沉淀还有Fe(OH)3
Fe(OH)3
.已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,可采用以下两种方法.
★还原法:在酸性介质中用FeSO4等将+6价铬还原成+3价铬.
具体流程如下:

有关离子完全沉淀的pH如下表:
(1)写出Cr2O72-与FeSO4溶液在酸性条件下反应的离子方程式
(2)还原+6价铬还可选用以下的
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.
则在操作②中可用于调节溶液pH的试剂为:
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
此时调节溶液的pH范围在
A.3~4 B.6~8 C.10~11 D.12~14
★电解法:将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去.
(4)写出阴极的电极反应式
(5)电解法中加入氯化钠的作用是:
查看习题详情和答案>>
★还原法:在酸性介质中用FeSO4等将+6价铬还原成+3价铬.
具体流程如下:

有关离子完全沉淀的pH如下表:
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
.(2)还原+6价铬还可选用以下的
BD
BD
试剂(填序号).A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.
则在操作②中可用于调节溶液pH的试剂为:
CD
CD
(填序号);A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
此时调节溶液的pH范围在
B
B
(填序号)最佳.A.3~4 B.6~8 C.10~11 D.12~14
★电解法:将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去.
(4)写出阴极的电极反应式
2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-
2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-
.(5)电解法中加入氯化钠的作用是:
增强溶液导电性
增强溶液导电性
. 电解高铁酸盐(如K2FeO4)是一种高效绿色氧化剂,可用于废水和生活用水的处理.从环境保护的角度看,制备高铁酸盐较好的方法为电解法:Fe+2NaOH+2H2O═Na2FeO4+H2↑.
电解高铁酸盐(如K2FeO4)是一种高效绿色氧化剂,可用于废水和生活用水的处理.从环境保护的角度看,制备高铁酸盐较好的方法为电解法:Fe+2NaOH+2H2O═Na2FeO4+H2↑.(1)采用铁片作阳极,NaOH溶液为电解质溶液,电解制备高铁酸钠,其电流效率可达到40%.写出阳极的电极反应式:
Fe-6e-+8OH-═FeO42-+4H2O
Fe-6e-+8OH-═FeO42-+4H2O
.(2)铁丝网电极是更理想的阳极材料,相同条件下,可将电流效率提高至70%以上,原因是
铁丝网的接触面积更大
铁丝网的接触面积更大
.研究亦发现,铁电极在某一电压范围内会生成Fe2O3膜而“钝化”,钝化的原因用反应式表示为因为铁电极上发生析氧反应4OH--4e-═O2↑+2H2O,氧气将铁氧化而得到氧化铁膜
因为铁电极上发生析氧反应4OH--4e-═O2↑+2H2O,氧气将铁氧化而得到氧化铁膜
.(3)FeO42-易与水反应生成絮状氢氧化铁,也会影响高铁酸盐的产率.若以铁丝网为阳极,在中间环节(对应图1中4h后)过滤掉氢氧化铁,合成过程中FeO42-浓度以及电流效率随时间的变化如图1中实线所示(图中曲线是每隔1h测得的数据).图中虚线部分对应于没有过滤氢氧化铁而连续电解的情况.下列判断正确的是
ACD
ACD
A.过滤掉氢氧化铁有利于获得较高浓度的高铁酸盐溶液
B.过滤掉氢氧化铁对电流效率影响不大
C.实验表明氢氧化铁的存在影响高铁酸盐浓度的增加
D.实验表明不过滤掉氢氧化铁,6h后电流效率几乎为0
(4)碱性条件下,高铁酸盐的稳定性与温度有关(如图2).随温度升高,高铁酸盐产率先增大后减小的原因是
升温电解一方面加快了高铁酸盐的生成速率,另一方面又加速FeO42-的分解
升温电解一方面加快了高铁酸盐的生成速率,另一方面又加速FeO42-的分解
.
(5)人们还对用铁的氧化物作电极制备高铁酸盐进行了研究,例如以磁铁矿多孔电极制备高铁酸盐,该研究方向的价值在于
BCD
BCD
A.将1mol Fe3O4氧化成高铁酸盐需10/3mol电子,可提高电流效率
B.以铁的氧化物为电极,可以实现变废(Fe3O4或铁锈)为宝(高铁酸盐)
C.自然界几乎没有铁单质,而有大量磁铁矿,该方法的原料来源广泛
D.磁铁矿作为多孔电极不会出现钝化现象.
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯.二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热.实验室以电解法制备ClO2的流程如图:
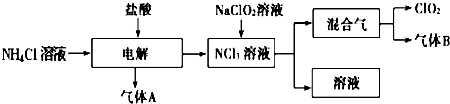
(1)ClO2中所有原子 (填“是”或“不是”)都满足8电子结构.上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用 .
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是 .
A.二氧化氯可广泛用于工业和饮用水处理
B.应用在食品工业中能有效地延长食品贮藏期
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
D.在工作区和成品储藏室内,要有通风装置和监测及警报装置
(3)欧洲国家主要采用氯酸钠氧化浓盐酸制备.化学反应方程式为 .缺点主要是产率低、产品难以分离,还可能污染环境.
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是 ,此法相比欧洲方法的优点是 .
(5)科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为 .此法提高了生产及储存、运输的安全性,原因是 .
查看习题详情和答案>>

(1)ClO2中所有原子
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是
A.二氧化氯可广泛用于工业和饮用水处理
B.应用在食品工业中能有效地延长食品贮藏期
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
D.在工作区和成品储藏室内,要有通风装置和监测及警报装置
(3)欧洲国家主要采用氯酸钠氧化浓盐酸制备.化学反应方程式为
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是
(5)科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为
 已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,可采用以下两种方法:
已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,可采用以下两种方法:★还原法:在酸性介质中用FeSO4等将+6价铬还原成+3价铬.
具体流程如下:

有关离子完全沉淀的pH如下表:
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
| O | 2- 7 |
Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
.(2)还原+6价铬还可选用以下的
BD
BD
试剂(填序号).A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.则在操作②中可用于调节溶液pH的试剂为
CD
CD
(填序号).A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
此时调节溶液的pH在
B
B
(填序号)范围最佳.A.3~4 B.6~8 C.10~11 D.12~14
★电解法:将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2
| O | 2- 7 |
(4)写出阴极的电极反应式
2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-
2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-
.(5)电解法中加入氯化钠的作用是
增强溶液导电性或盐析
增强溶液导电性或盐析
.(6)若外接电源为熔融碳酸盐燃料电池,其工作原理示意图如图,则熔融碳酸盐燃料电池的正极反应可表示为
O2+4e-+2CO2═2CO32-
O2+4e-+2CO2═2CO32-
.