摘要:105.向VmLBaCI2溶液中加入一定体积的0.05 mol·L-1的硫酸溶液,两者恰好完全反应,且反应后的溶液的pH为3.0,则原BaCI2溶液的物质的量浓度是 A. 5.05×10-4 mol·L-1 B. 5.05×10-3 mol·L-1 C. 1.01×10-4 mol·L-1 D. 1.01×10-3 mol·L-1
网址:http://m.1010jiajiao.com/timu3_id_50831[举报]
根据下列要求写出有关反应式:
(1)钢铁发生吸氧腐蚀时,正极反应式: ;
(2)用石墨作电极电解饱和食盐水的总反应: ;
(3)将石墨接负极,铜板接正极,当通以直流电时,电解硫酸铜溶液,发生氧化反应的电极反应式: ;
(4)向明矾溶液中逐滴加入氢氧化钡溶液至硫酸根离子刚好沉淀完全时,离子反应方程式: ;
(5)蒸干AlCl3溶液,并灼烧.涉及到的化学反应方程式: .
查看习题详情和答案>>
(1)钢铁发生吸氧腐蚀时,正极反应式:
(2)用石墨作电极电解饱和食盐水的总反应:
(3)将石墨接负极,铜板接正极,当通以直流电时,电解硫酸铜溶液,发生氧化反应的电极反应式:
(4)向明矾溶液中逐滴加入氢氧化钡溶液至硫酸根离子刚好沉淀完全时,离子反应方程式:
(5)蒸干AlCl3溶液,并灼烧.涉及到的化学反应方程式:
下列实验操作与预期实验目的或所得实验结论一致的是( )
查看习题详情和答案>>
| 选项 | 实验操作及现象 | 实验目的或结论 |
| A | 向1,2两试管中分别加入等浓度H2O2溶液10mL、1mL,再向H2O2溶液中分别滴入等浓度等体积CuSO4、FeCl3溶液;试管2中产生气体较快 | 证明FeCl3溶液的催化效率更高 |
| B | 将洁净的铁钉在饱和食盐水中浸泡一段时间;铁钉上有气泡产生 | 证明铁发生析氢腐蚀 |
| C | 测定物质的量浓度相同的盐酸和醋酸溶液的pH;盐酸pH小于醋酸pH | 证明盐酸酸性比醋酸强 |
| D | 硅酸钠溶液中滴入酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失 | 证明非金属性:Cl>Si |
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物,实验室以孔雀石为原料制备CuSO4?5H2O及CaCO3,步骤如下:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+.从下列所给试剂中选择并填写字母:检验溶液A中Fe3+的最佳试剂为
a.KMnO4b.KI c.H2O2d.KSCN
(2)实验中CuO的作用是
(3)由溶液C获得CuSO4?5H2O,需要经过蒸发浓缩,
(4)制备CaCO3时,向CaCl2溶液中先通入

查看习题详情和答案>>
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+.从下列所给试剂中选择并填写字母:检验溶液A中Fe3+的最佳试剂为
d
d
;实验步骤中试剂①为c
c
.a.KMnO4b.KI c.H2O2d.KSCN
(2)实验中CuO的作用是
消耗溶液中的H+调节pH,使Fe3+沉淀
消耗溶液中的H+调节pH,使Fe3+沉淀
.(3)由溶液C获得CuSO4?5H2O,需要经过蒸发浓缩,
冷却结晶
冷却结晶
、过滤
过滤
等操作.(4)制备CaCO3时,向CaCl2溶液中先通入
NH3
NH3
(填CO2或NH3),通入CO2气体时应选用下列d
d
(填字母,下同)装置;若实验过程中有氨气逸出,应选用下列b
b
装置回收.
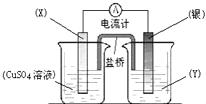 依据氧化还原反应:2Ag+(aq)+Cu(s)?Cu2+(aq)+2Ag(s)设计的原电池如图所示.下列说法不正确的是( )
依据氧化还原反应:2Ag+(aq)+Cu(s)?Cu2+(aq)+2Ag(s)设计的原电池如图所示.下列说法不正确的是( )| A、电极X的材料是铜 | B、电解质溶液Y是硝酸银溶液 | C、银电极为电池的正极,发生的电极反应为:Ag++e-?Ag | D、盐桥中的阳离子向硫酸铜溶液中运动 |
下列实验方案不能达到实验目的是( )
|
| A、A | B、B | C、C | D、D |