网址:http://m.1010jiajiao.com/timu3_id_50594[举报]
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
⑴O、Si、N元素的电负性由大到小的顺序是____________________。C60和金刚石都是碳的同素异形体,二者中熔点较高的是____________。
⑵A为短周期金属元素,依据下表数据,A的基态原子的轨道表示式为
________________________________。
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
⑶过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道的电子排布有关。一般地,若为d0或d10排布时,无颜色;若为d1~d9排布时,有颜色;如[Cu(H2O)4]2+显蓝色。据此判断25号元素Mn形成的络合离子[Mn(H2O)6]2+_____(填“有”或“无”)颜色。
⑷H-C≡C-COOH分子内含有的σ键、π键的个数依次为_______________,其中碳原子的杂化方式为___________________。
⑸CO可以与金属铁形成配合物分子Fe(CO)5。Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g),反应过程中,断裂的化学键只有配位键,则形成的化学键的类型是______________。
⑹W元素的原子的M能层为全充满状态,且核外的未成对电子只有一个,W晶体中微粒的堆积方式是下图中 (选填“甲”、“乙”或“丙”);若W晶体中一个晶胞的边长为a cm,则W晶体的密度为 (写出含a的表达式,用NA表示阿伏加德罗常数)。
甲 乙 丙
查看习题详情和答案>>
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
⑴O、Si、N元素的电负性由大到小的顺序是____________________。C60和金刚石都是碳的同素异形体,二者中熔点较高的是____________。
⑵A为短周期金属元素,依据下表数据,A的基态原子的轨道表示式为
________________________________。
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
⑷H-C≡C-COOH分子内含有的σ键、π键的个数依次为_______________,其中碳原子的杂化方式为___________________。
⑸CO可以与金属铁形成配合物分子Fe(CO)5。Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g),反应过程中,断裂的化学键只有配位键,则形成的化学键的类型是______________。
⑹W元素的原子的M能层为全充满状态,且核外的未成对电子只有一个,W晶体中微粒的堆积方式是下图中 (选填“甲”、“乙”或“丙”);若W晶体中一个晶胞的边长为a cm,则W晶体的密度为 (写出含a的表达式,用NA表示阿伏加德罗常数)。



甲 乙 丙 查看习题详情和答案>>
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
⑴O、Si、N元素的电负性由大到小的顺序是____________________。C60和金刚石都是碳的同素异形体,二者中熔点较高的是____________。
⑵A为短周期金属元素,依据下表数据,A的基态原子的轨道表示式为
________________________________。
|
电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
|
A |
932 |
1821 |
15390 |
21771 |
⑶过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道的电子排布有关。一般地,若为d0或d10排布时,无颜色;若为d1~d9排布时,有颜色;如[Cu(H2O)4]2+显蓝色。据此判断25号元素Mn形成的络合离子[Mn(H2O)6]2+_____(填“有”或“无”)颜色。
⑷H-C≡C-COOH分子内含有的σ键、π键的个数依次为_______________,其中碳原子的杂化方式为___________________。
⑸CO可以与金属铁形成配合物分子Fe(CO)5。Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g),反应过程中,断裂的化学键只有配位键,则形成的化学键的类型是______________。
⑹W元素的原子的M能层为全充满状态,且核外的未成对电子只有一个,W晶体中微粒的堆积方式是下图中 (选填“甲”、“乙”或“丙”);若W晶体中一个晶胞的边长为a cm,则W晶体的密度为 (写出含a的表达式,用NA表示阿伏加德罗常数)。



甲 乙 丙
查看习题详情和答案>>
⑴O、Si、N元素的电负性由大到小的顺序是____________________。C60和金刚石都是碳的同素异形体,二者中熔点较高的是____________。
⑵A为短周期金属元素,依据下表数据,A的基态原子的轨道表示式为
________________________________。
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
⑷H-C≡C-COOH分子内含有的σ键、π键的个数依次为_______________,其中碳原子的杂化方式为___________________。
⑸CO可以与金属铁形成配合物分子Fe(CO)5。Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g),反应过程中,断裂的化学键只有配位键,则形成的化学键的类型是______________。
⑹W元素的原子的M能层为全充满状态,且核外的未成对电子只有一个,W晶体中微粒的堆积方式是下图中 (选填“甲”、“乙”或“丙”);若W晶体中一个晶胞的边长为a cm,则W晶体的密度为 (写出含a的表达式,用NA表示阿伏加德罗常数)。



甲 乙 丙
研究物质的微观结构,有助于人们理解物质变化的本质.请回答下列问题.
(1)C、Si、N元素的电负性由大到小的顺序是
(2)A、B均为短周期金属元素.依据下表数据,写出B原子的电子排布式:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等.
①COCl2分子的结构式为
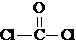 ,②COCl2分子内含有
,②COCl2分子内含有A.4个σ键 B.2个σ键、2个π键
C.2个σ键、1个π键 D.3个σ键、1个π键
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5=Fe(s)+5CO,反应过程中,断裂的化学键只有配位键,形成的化学键是