摘要:41.金属Na Mn Al分别跟足量的盐酸充分反应手.若生成氢气的质量相同时 A.参加反应的Na Mn Al的原子个数比为3∶2∶1 B.参加反应的Na Mn Al的原子个数比为6∶3∶2 C.参加反应的Na Mn Al的质量比为1∶1∶ 1 D.生成的氢气在相同条件下的体积比为1∶2∶3
网址:http://m.1010jiajiao.com/timu3_id_502[举报]
O2________ H2________ Mn________ Ba________
F2________ He________ Pb________ Fe________
Cl2________ Ne________ I2________ Ar________
H2O________ CaO________ CuO________ CO________
CO2________ SO2________ NO________ Na2O________
N2O5________ Fe2O3________ FeO________ Fe3O4________
MgO________ Al2O3________ HgO________ Na2O________
NaCl________ KCl________ CaCl2________ MgCl2________
AlCl3________ ZnCl2________ FeCl2________ FeCl3________
CuCl2________ AgCl________ BaCl2________ Fe2S3________
Na2S________ FeS________ HCl________ H2SO4________
NaOH________ NaNO3________ Na2SO4________ Na2CO3________
KOH________ KNO3________ K2SO4________ K2CO3________
Ca(OH)2________ Ca(NO3)2________ CaSO4________ CaCO3________
Al(OH)3________ Al(NO3)3________ Al2(SO4)3________ H2CO3________
Ba(OH)2________ Ba(NO3)2________ BaSO4________ BaCO3________
Cu(OH)2________ Cu(NO3)2________ CuSO4________ NH4Cl________
NH4NO3________ HNO3________.
查看习题详情和答案>>
 学过金属的活动性顺序以后,明明同学对其一系列知识进行了研究.
学过金属的活动性顺序以后,明明同学对其一系列知识进行了研究.
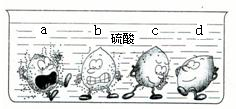
(1)据下图中的实验现象判断,稀硫酸里a、b、c、d四种金属中,位于氢后面的金属是______.
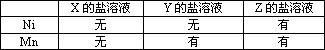
(2)将金属Ni、Mn分别放入其他三种金属X、Y、Z的盐溶液中,反应的结果和有无金属析出的情况如右表所示.则它们的金属活动性由强到弱的顺序为(______)
| X盐溶液 | Y盐溶液 | Z盐溶液 | |
| Ni | 无 | 无 | 有 |
| Mn | 无 | 有 | 有 |
B.Z Ni Y Mn X
C.X Mn Y Ni Z
D.X Mn Ni Y Z
(3)查阅资料:金属在活动性顺序里的位置越靠后,其化合物越不稳定,所以它的氧化物越易被还原.请你写出下列用金属氧化物制取金属的化学方程式:
①金属氧化物加热分解:______;
②用碳还原金属氧化物:______;
(4)查阅资料:在金属活动性顺序里,位于氢后面的金属铜在常温下虽然不能与稀盐酸、
稀硫酸反应,但可以与浓硫酸在加热时发生反应,其反应的化学方程式为:
Cu+2H2SO4(浓)?CuSO4+SO2↑+2H2O
反应生成的SO2是一种无色、能溶于水、有刺激性气味的气体.若用该方法制取硫酸铜,应用______溶液将生成的SO2吸收,其目的是______.
(5)请你利用所学知识设计一种以铜、稀硫酸为主要原料制取硫酸铜的方法.(用化学方程式表示)
(6)向12.8g铜中加入40g浓硫酸溶液,恰好完全反应,计算生成SO2的质量(方程式见上)和反应前硫酸溶液中溶质的质量分数. 查看习题详情和答案>>