网址:http://m.1010jiajiao.com/timu3_id_49853[举报]
 (8分)为了减少污染,使实验绿色化,学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如右图所示),在圆心处放置2粒芝麻大小的KClO3晶体,盖好表面皿。
(8分)为了减少污染,使实验绿色化,学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如右图所示),在圆心处放置2粒芝麻大小的KClO3晶体,盖好表面皿。
打开表面皿,向KClO3晶体滴加一滴浓盐酸,再立即将表面皿盖好,试描述下列各处反应的现象,并写出相应的离子方程式。
(提示:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O)
a处:
b处:
c处:
d处:
查看习题详情和答案>>
(10分)为了减少污染,使实验绿色化,学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如右图所示),在圆心处放置2粒芝麻大小的KClO3晶体,盖好表面皿。
打开表面皿,向KClO3晶体滴加一滴浓盐酸,再立即将表面皿盖好,试描述反应的现象,并写出相应的化学方程式。
e处:
a处:
b处:
c处:
d处:
查看习题详情和答案>>为了减少污染,使实验绿色化,学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻大小的KClO3晶体,盖好表面皿.
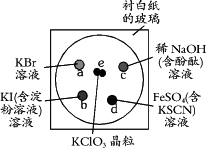
打开表面皿,向KClO3晶体滴加一滴浓盐酸,再立即将表面皿盖好,试描述下列各处反应的现象,并写出相应的离子方程式.
(提示:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O)
a处:________________________
b处:________________________
c处:________________________
d处:________________________

下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L—1计算)。
| | 开始沉淀的pH | 沉淀完全的pH | 沉淀溶解的pH |
| Cu2+ | 4.4 | 6.4 | |
| Al3+ | 3.0 | 5.0 | 10 |
| Zn2+ | 5.9 | 8.9 | 11 |

②由表可知Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2—,请写出金属锌与氢氧化钠溶液反应的离子方程式
(2)为了符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:空气为氧化剂法
将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加入物质甲调节pH,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全。已知:Ksp[Fe((OH)3]≈10-38,然后过滤、浓缩、结晶。
请回答下列问题:
①方案为了使铁离子全部沉淀,应调节pH至少为 。
②方案中甲物质可选用的是
A.CaO B.NaOH C.CuCO3 D.Cu2(OH) 2CO3 E.Fe2(SO4) 3
③方案中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因 。
第二组:过氧化氢为氧化剂法
将铜粉放到 1.5 mol·L-1的足量稀硫酸中,控温在50℃加入10%的足量H2O2反应0.5 h,升温到60℃,持续反应1 h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 。
请回答下列问题:
④用过氧化氢为氧化剂法比流程中采用硝酸和硫酸溶解的优点是 。
⑤用少量95%的酒精淋洗的目的是 。
(3)废铜溶解后经过一系列操作得到硫酸铜溶液,补充完整由溶解液制备纯净硫酸铜溶液的实验步骤 。