网址:http://m.1010jiajiao.com/timu3_id_49701[举报]
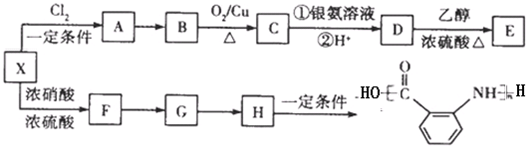
已知有机物A、B、C、D、E、F有以下转化关系。A为气态烃,标况下的密度为1.25g/L;E是不溶于水且具有香味的无色液体,相对分子质量是C的2倍;F 为高分子化合物。结合下图关系回答问题:

(1).写出C的结构简式: ;
(2)写出B、D中官能团的名称:B 、D ;
(3)写出下列反应的化学方程式:
② ;
④ ;
( 4 )写出C与新制氢氧化铜悬浊液反应的化学方程式 ;
(5)物质B可以直接被氧化为D,需要加入的试剂是 ;
(6)A与苯、甲苯都是石油化工的重要产品,按要求回答下列问题:
甲苯可以发生取代反应,写出由甲苯制备TNT.的化学方程式 。
查看习题详情和答案>>
已知:①X的核磁共振氢谱中有4个信号峰,其峰面积之比为2:2:1:3;
②苯环上的甲基可以被酸性KMnO4溶液氧化成羧基;苯环侧链的硝基在Fe/HCl作用下被还原为氨基,且苯环侧链上的氨基易被氧化.
请回答下列问题:
(1)有机物X的结构简式为
(2)写出反应类型:A→B
(3)下列关于有机物B的说法正确的是
a.分子式为C7H8O b.遇FeCl3溶液显紫色
c.一定条件下能与D发生酯化反应 d.能和金属钠或NaOH溶液反应
(4)写出下列反应的化学方程式:
①D→E:
②H→
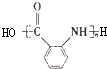 :
:(5)E有多种同分异构体,同时符合下列条件的同分异构体共有
①与E具有相同的官能团;②苯环上只有一个甲基;③苯环上的一氯代物仅有2种.

已知:①芳香族化合物笨环上的氢原子可被卤代烷中的烷基取代.如:
 +RX
+RX| 催化剂 |
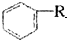 +HX(R.是烃基,X为卤原子)
+HX(R.是烃基,X为卤原子)②0.01mol C质量为1.08g,能与饱和溴氷完全反应生成3.45g白色沉淀,E不能使Br2的CCl4溶液褪色.
③G的核磁共振級谱有3种峰,其峰面积之比为3:2:1,G与NaHCO3溶液反应放出气体.根据以上信息回答以下问题:
(1)化合物A的名称为
(2)下列说法正确的是(填选项字母)
a.B可使酸性高锰酸钾溶液褪色
b.C不存在芳香族醛类同分异构体
c.D的酸性比E弱
d.F不能使溴水褪色
(3)①E和G反应生成H的化学方程式为
②PMnMA的结构简式为
(4)G的能水解的链状同分异构体有
即可)
(1)一氯胺的空间结构为? ?形,电子式为? ?。?
(2)若把氨基换成乙基,则构成的物质A属于? ?类有机物,A在碱性溶液中能发生水解反应的方程式是 。?
(3)若由A通过反应,最终可以制得乙酸乙酯,反应过程可能涉及到的反应类型有 。(用A、 B…表示)?
①取代反应 ②加成反应 ③氧化反应 ④消去反应 ⑤酯化反应?
A.①⑤ B.①③⑤? C.②④⑤ D.①②④?
Ⅱ已知有机物A~F有如下转化关系?

①A的分子式为C10H20O2。②B分子中有两个甲基。?③D、E互为具有相同官能团的同分异构体。D能与碳酸氢钠溶液反应放出CO2,E分子烃基上的氢原子若被Cl取代,其一氯代物有3种。④F可以使溴的四氯化碳溶液褪色,G为高分子化合物。?
(1)B可以发生的反应有? ?(选填序号)。?
①取代反应 ②消去反应 ③加聚反应 ④氧化反应?
(2)D、F分子所含的官能团的名称依次是? ?、? ? 。?
(3)写出与D、E具有相同官能团的同分异构体的可能结构简式: 。?
(4)写出下列转化的化学方程式?
B+E→A ;?
F→G 。?
查看习题详情和答案>>(15分)
苯甲醚可用作有机合成原料,如合成树脂、香料等。苯甲醚最初是从蒸馏水杨酸甲酯或甲氧基苯甲酸得到,产量受到限制。以下是某研究小组开发的生产苯甲醚的合成路线:

已知以下信息:
①A属于烯烃;②B不能使溴水因反应而褪色;③C遇FeCl3溶液显紫色;请回答下列问题:
(1)A的结构简式为 ;
(2)②的反应类型是 ;①的化学方程式为 ;
(3)反应③除C外还有一种生成物,该物质是一种常用的有机溶剂,请写出其结构简式 ;
(4)B能被酸性高锰酸钾溶液氧化,其氧化产物含有的官能团的名称为 ,该产物的同分异构体中属于芳香族化合物的有 种,其中在核磁共振氢谱中出现6组峰和4组峰的产物个数比为 。
查看习题详情和答案>>