摘要:27.新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4.M=Mn.Zn.Ni且均显+2价.下同)由铁酸盐(MFe2O4)经高温还原而得.常温下.它能使工业废气中的酸性氧化物分解除去.转化流程如图所示: (1)已知铁酸盐(MFe2O4)被H2高温还原时.发生反应的MFe2O4与H2的物质的量之比为2︰1.则还原产物MFe2Ox中x= .MFe2Ox中+2价铁与+3价铁的量之比为 . (2)在酸性溶液中.Fe2O42-易转化为Fe2+: Fe2O42-+2e-+8H+→2Fe2++4H2O 有KMnO4.Na2CO3.Cu2O.Fe2(SO4)3四种物质中的一种能使上述还原过程发生.写出该氧化还原反应的离于方程式并配平 .
网址:http://m.1010jiajiao.com/timu3_id_49696[举报]
 氮的氧化物和SO2是常见的化工原料,但也是大气的主要污染物.综合治理其污染是化学家研究的主要内容.根据题意完成下列各题:
氮的氧化物和SO2是常见的化工原料,但也是大气的主要污染物.综合治理其污染是化学家研究的主要内容.根据题意完成下列各题:(1)用甲烷催化还原一氧化氮,可以消除一氧化氮对大气的污染.反应方程式如下:CH4(g)+4NO(g)?2N2(g)+2H2O(g)+CO2(g)该反应平衡常数表达式为
(2)硫酸生产中,接触室内的反应:2SO2(g)+O2(g)
| ||
(3)右图平衡状态由A变到B时,改变的外界条件是
a.又加入一些催化剂 b.又加入一些氧气 c.降低了体系的温度 d.升高了外界的大气压
(4)新型纳米材料氧缺位铁酸盐MFe2Ox在常温下,能将氮的氧化物和SO2等废气分解除去.转化流程如图2所示,若x=3.5,M为Zn,请写出ZnFe2O3.5分解SO2的化学方程式
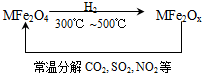 新型纳米材料氧缺位铁酸盐(MFe2Ox )(3<x<4;M表示Mn、Co、Zn或Ni的二价离子),常温下,它能使工业废气中的SO2、NO2等氧化物转化为单质.转化流程如图所示:有关上述转化过程的下列叙述正确的是( )
新型纳米材料氧缺位铁酸盐(MFe2Ox )(3<x<4;M表示Mn、Co、Zn或Ni的二价离子),常温下,它能使工业废气中的SO2、NO2等氧化物转化为单质.转化流程如图所示:有关上述转化过程的下列叙述正确的是( )
查看习题详情和答案>>
 (2009?抚顺模拟)二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物.综合治理其污染是环境化学当前的重要研究内容之一.
(2009?抚顺模拟)二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物.综合治理其污染是环境化学当前的重要研究内容之一.(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)
| 催化剂 | △ |
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa.该反应的平衡常数等于
800
800
.②平衡状态由A变到B时,平衡常数K(A)
=
=
K(B)(填“>”、“<”或“=”).(2)用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ/mol
若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总数为
1.60NA(或1.6NA)
1.60NA(或1.6NA)
(阿伏加德罗常数的值用NA表示),放出的热量为173.4
173.4
kJ.(3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去.转化流程如图所示:

请写出MFe2Ox分解SO2的化学方程式
MFe2Ox+SO2→MFe2O4+S
MFe2Ox+SO2→MFe2O4+S
(不必配平).新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Zn、Ni,且均为+2价,下同)是由铁酸盐MFe2O4经过高温反应得到的.
(1)将纳米材料氧缺位铁酸盐分散在蒸馏水中,所形成的分散系属于
(2)MFe2O4中Fe元素的化合价为
(3)铁酸盐MFe2O4经过高温反应得到MFe2Ox的反应属于
(4)在酸性条件下,Fe2O42-容易转化为Fe2+,某反应体系中共存在下列6种粒子:Fe2O42-、Fe2+、H+、H2O、Cu2O、Cu2+,则该反应中的氧化剂是
查看习题详情和答案>>
(1)将纳米材料氧缺位铁酸盐分散在蒸馏水中,所形成的分散系属于
胶体
胶体
.(2)MFe2O4中Fe元素的化合价为
+3
+3
.(3)铁酸盐MFe2O4经过高温反应得到MFe2Ox的反应属于
氧化还原
氧化还原
(填“氧化还原”或“非氧化还原”)反应.(4)在酸性条件下,Fe2O42-容易转化为Fe2+,某反应体系中共存在下列6种粒子:Fe2O42-、Fe2+、H+、H2O、Cu2O、Cu2+,则该反应中的氧化剂是
Fe2O42-
Fe2O42-
,还原剂是Cu2O
Cu2O
.(2010?南通模拟)二氧化硫和氮的氧化物是大气的主要污染物,关注臭氧层、防止和治理环境污染是当前环保工作的重要研究内容之一.
(1)空气中微量的臭氧对人有益,浓度过大则是一种污染气体,臭氧作为强氧化剂,几乎能与任何生物组织反应.下列有关说法正确的是
A.停止使用氟里昂是为保护臭氧层
B.光化学烟雾与大气臭氧的生成有关
C.家用电器消毒柜中产生的臭氧能够高效杀菌消毒
D.臭氧能使湿润的碘化钾-淀粉试纸变蓝
(2)一定条件下,2SO2(g)+O2(g)?2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和0.2mol SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,则该可逆反应的平衡常数K=
(3)臭氧的化学性质极不稳定,在空气和水中都会慢慢分解成氧气,臭氧常用于自来水的消毒,臭氧的溶解度及在水中的分解速度与水温及水的pH关系如图:

用臭氧消毒自来水,适宜的条件是
(4)新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如图所示:
若2mol ZnFe2Ox与SO2可生成0.75mol S,x=
查看习题详情和答案>>
(1)空气中微量的臭氧对人有益,浓度过大则是一种污染气体,臭氧作为强氧化剂,几乎能与任何生物组织反应.下列有关说法正确的是
ABCD
ABCD
.A.停止使用氟里昂是为保护臭氧层
B.光化学烟雾与大气臭氧的生成有关
C.家用电器消毒柜中产生的臭氧能够高效杀菌消毒
D.臭氧能使湿润的碘化钾-淀粉试纸变蓝
(2)一定条件下,2SO2(g)+O2(g)?2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和0.2mol SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,则该可逆反应的平衡常数K=
5.76
5.76
;恒温下,若往容器中再加入2mol SO2(g),则重新达到平衡时SO2的总转化率<
<
50%(选填“>”、“<”或“=”).(3)臭氧的化学性质极不稳定,在空气和水中都会慢慢分解成氧气,臭氧常用于自来水的消毒,臭氧的溶解度及在水中的分解速度与水温及水的pH关系如图:

用臭氧消毒自来水,适宜的条件是
低温,水的pH控制7或弱碱性
低温,水的pH控制7或弱碱性
.
(4)新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如图所示:
若2mol ZnFe2Ox与SO2可生成0.75mol S,x=
3.25
3.25
.