网址:http://m.1010jiajiao.com/timu3_id_49318[举报]
(10分)实验小组测定某肥料中的总氮含量(以氮的质量分数表示) ,实验装置如下图(图中加热及夹持仪器略去):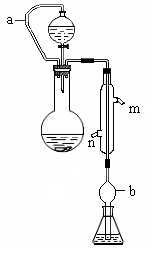
称取1.200 g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在碱性溶液中蒸馏氨,用25.00 mL浓度为0.5000 mol/L-1硫酸溶液充分吸收,再用浓度为0.1000 mol/L-1氢氧化钠溶液滴定未反应的硫酸。重复上述实验三次。实验数据如下:
| 实验次数 | 氢氧化钠溶液的体积 | |
| 滴定前刻度(mL) | 滴定后刻度(mL) | |
| 1 | 0.00 | 5. 01 |
| 2 | 6.00 | 10.99 |
| 3 | 12.00 | 17.60 |
(1)写出圆底烧瓶内发生反应的离子方程式 。
(2)分液漏斗和圆底烧瓶之间的导管a的作用是 ; b的作用是
;冷凝管中从(填“n”或“m”) 口进水。
(3)在滴定过程中,以下操作会使所测总氮含量偏小的是(填序号) 。
| A.锥形瓶水洗后未烘干 | B.滴定过程中滴定管有漏水现象 |
| C.滴定过程中有少量溶液从锥形瓶中溅出 | D.滴定前滴定管内有气泡,滴定后没有了 |
(5)利用题目中所给数据计算肥料中总氮含量为 %(计算结果保留到小数点后1位)。 查看习题详情和答案>>
(13分)物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识的回答:
(1)A为0.1 mol•L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为 。
(2)B为0.1 mol•L-1NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(共3个,分别用离子方程式表示): ;实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因: 。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入 ,目的是 ;若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为 。
(4)D为含有足量AgCl固体的饱和溶液,AgCl在水中存在沉淀溶解平衡:
AgCl(s) Ag+(aq)+Cl-(aq), 在25℃时,AgCl的Ksp=1.8×10-10
Ag+(aq)+Cl-(aq), 在25℃时,AgCl的Ksp=1.8×10-10
25oC时,现将足量AgCl分别放入:①l00mL蒸馏水;②l00mL 0.2 mol•L-1AgNO3溶液;③100mL 0.1 mol•L-1氯化铝溶液;④100mL 0.1 mol•L-1盐酸溶液。充分搅拌后,相同温度下Ag+浓度由大到小的顺序是 (填写序号);②中C1-的浓度为 _ mol•L-1。
查看习题详情和答案>>
(共10分)请按要求回答下列问题:
(1)硅在无机非金属材料中一直扮演着重要角色,被誉为无机非金属材料的主角。
①下列物品用到硅单质的是 ;
| A.玻璃制品 | B.石英钟表 | C.计算机芯片 | D.光导纤维 E.太阳能电池 |
(2)Cl2和SO2都具有漂白性,但将这两种气体按体积比1:1通入水中得到的溶液却几乎没有漂白性,写出Cl2和SO2 1:1通入水中发生的离子反应方程式:______________________________________________________;
(3)写出二氧化硫与双氧水反应的化学方程式,并标出电子转移方向和数目: ______________________ 。 查看习题详情和答案>>
(共10分) G 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
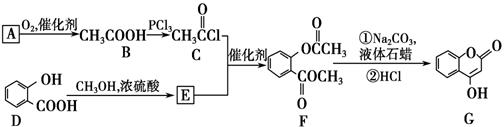
(1)A与银氨溶液反应有银镜生成,则A的分子式是________。(1分)
(2)B―→ C的反应类型是________。(1分)
(3)C与E反应生成F的化学方程式________________________________(2分)
(4)F的一种同分异构体能水解且苯环上的一氯代物有一种,任意写出其中一种的结构简式________。(2分)
(5)写出F和过量NaOH溶液共热时反应的化学方程式:
__________________________________________________________。(2分)
(6)下列关于G的说法正确的是________。(2分)
a.能与金属钠反应
b.1 mol G最多能和5 mol氢气反应
c.分子式是C9H6O3
d.1molG最多和3molNaOH反应
查看习题详情和答案>>
(10分)W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
(1)W的气态氢化物化学式为 ,它的沸点比PH3的沸点 ,
(填“高”或“低”)W的气态氢化物稳定性比H2O(g)________(填“强”或“弱”)。
(2)Y的基态原子核外电子排布式是________ ______,Y的第一电离能比X的______ __(填“大”或“小”)。
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
。
(4)已知下列数据:
Fe(s)+1/2O2(g)===FeO(s) ΔH=-272.0 kJ·mol-1
2X(s)+3/2O2(g)===X2O3(s) ΔH=-1 675.7 kJ·mol-1
X的单质和FeO反应的热化学方程式是___________ ___________________。
查看习题详情和答案>>