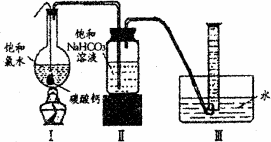
摘要:在圆底烧瓶底部.有一用塑料网包住的过量块状碳 酸钙和150mL饱和氯水.按如图所示装置实验.待不 再产生气泡后.将塑料网中剩余的石灰石提出液面. 密封后再加热.煮沸烧瓶中的液体.直到量筒中的气 体不再增加.请回答: (3)为减少用装置Ⅲ收集气体过程中CO2因溶解而造 成的损失.且水槽中仍然为水.请你对装置Ⅲ进行改进.最简单的方法是 . (4)用改进后的装置进行上述实验.测得塑料网内的碳酸钙质量减少Ag.总共收集到标准状况下的CO2气体BL.发现B/22.4 moL明显小于A/100 moL.若不考虑实验操作和CO2的溶解等因素造成的误差.从化学反应原理来看.导致这一大小关系的原因是 . (5)实验后发现.装置Ⅱ中的液体增多了.其原因是 .16.硫酸铵是一种常用的铵态氮肥.下表是硫酸铵化肥品质的主要指标. 指标 项目 优等品 一等品 合格品 外观 白色结晶.无可见机械杂质 无可见机械杂质 氮(N)含量 ≥21.0% ≥21.0% ≥20. 5% 某化学研究性学习小组为本地农业生产服务.对某农用品商店出售的一等品硫酸铵化肥的品质进行探究. [观察外观] 该硫酸铵化肥无可见机械性杂质. [实验探究] 按右图所示装置进行实验. (1)烧瓶内发生反应的离子方程式为: 烧杯中盛放的试剂最好是 (填“浓硫酸 .“稀硫酸 或“水 ) (2)实验过程中.需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原因是 [交流讨论] 甲同学:根据此实验测得的数据.计算硫酸铵化肥的含氮量可能偏高.因为实验装置中存在一个明显缺陷是: 乙同学:实验装置中还存在另一个明显缺陷是: 经过大家充分讨论一致认为:针对甲.乙两位同学指出的实验装置中存在的明显缺陷.需改进实验装置.重新进行实验. [探究结论] 称取13.5 g硫酸铵化肥样品.用改进后的实验装置重新进行实验.测得实验后B装置增重3.4 g.则该化肥 一等品
网址:http://m.1010jiajiao.com/timu3_id_48743[举报]
| |||||||||||||||
 实验一、定性探究:
实验一、定性探究:①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生.
经检测,上述实验中产生的无色气体均为CO2.请回答:
(1)试解释可以在饱和氯水中加入石灰石制备HClO的原因
在饱和氯水中存在如下平衡:Cl2+H2O HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO
HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO
 HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO
HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO在饱和氯水中存在如下平衡:Cl2+H2O HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO
HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO
. HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO
HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO(2)写出步骤③中第一份及第二份滤液发生反应的离子方程式:
第一份:
Ca2++HCO3-+OH-=CaC03↓+H2O
Ca2++HCO3-+OH-=CaC03↓+H2O
.第二份:
HCO3-+H+=CO2↑+H2O
HCO3-+H+=CO2↑+H2O
.(3)试根据所学知识推测,在②的滤液中含 有的溶质,除了溶解的极少量氯气外,还含有的其它溶质为(写化学式)
HClO、Ca(HCO3)2、CaCl2
HClO、Ca(HCO3)2、CaCl2
.实验二、定量探究:
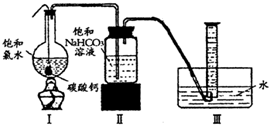
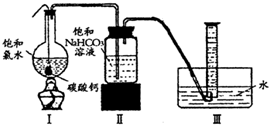
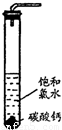
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如右图所示装置(部分夹持、支撑仪器没有画出)实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加.请回答:
(4)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,水槽中的水应换为
B
B
.A.饱和碳酸钠溶液 B.饱和碳酸氢钠溶液 C.饱和食盐水
(5)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少Ag,总共收集到标准状况下的CO2气体BL,发现
| BL |
| 22.4L/mol |
| Ag |
| 100g/mol |
碳酸钙与氯水反应生成的Ca(HC03)2再受热时,除生成CO2外,还生成了CaC03
碳酸钙与氯水反应生成的Ca(HC03)2再受热时,除生成CO2外,还生成了CaC03
. 实验一、定性探究:
实验一、定性探究:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生.
经检测,上述实验中产生的无色气体均为CO2.请回答:
(1)试解释可以在饱和氯水中加入石灰石制备HClO的原因______.
(2)写出步骤③中第一份及第二份滤液发生反应的离子方程式:
第一份:______.
第二份:______.
(3)试根据所学知识推测,在②的滤液中含 有的溶质,除了溶解的极少量氯气外,还含有的其它溶质为(写化学式)______.
实验二、定量探究:
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如右图所示装置(部分夹持、支撑仪器没有画出)实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加.请回答:
(4)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,水槽中的水应换为______.
A.饱和碳酸钠溶液 B.饱和碳酸氢钠溶液 C.饱和食盐水
(5)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少Ag,总共收集到标准状况下的CO2气体BL,发现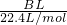 明显小于
明显小于 .若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是______.
.若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是______.
查看习题详情和答案>>
实验一、定性探究:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生.
经检测,上述实验中产生的无色气体均为CO2.请回答:
(1)试解释可以在饱和氯水中加入石灰石制备HClO的原因______.
(2)写出步骤③中第一份及第二份滤液发生反应的离子方程式:
第一份:______.
第二份:______.
(3)试根据所学知识推测,在②的滤液中含 有的溶质,除了溶解的极少量氯气外,还含有的其它溶质为(写化学式)______.
实验二、定量探究:
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如右图所示装置(部分夹持、支撑仪器没有画出)实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加.请回答:
(4)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,水槽中的水应换为______.
A.饱和碳酸钠溶液 B.饱和碳酸氢钠溶液 C.饱和食盐水
(5)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少Ag,总共收集到标准状况下的CO2气体BL,发现
明显小于
.若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是______.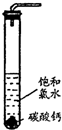
查看习题详情和答案>>
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生.
经检测,上述实验中产生的无色气体均为CO2.请回答:
(1)试解释可以在饱和氯水中加入石灰石制备HClO的原因______.
(2)写出步骤③中第一份及第二份滤液发生反应的离子方程式:
第一份:______.
第二份:______.
(3)试根据所学知识推测,在②的滤液中含 有的溶质,除了溶解的极少量氯气外,还含有的其它溶质为(写化学式)______.
实验二、定量探究:

在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如右图所示装置(部分夹持、支撑仪器没有画出)实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加.请回答:
(4)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,水槽中的水应换为______.
A.饱和碳酸钠溶液 B.饱和碳酸氢钠溶液 C.饱和食盐水
(5)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少Ag,总共收集到标准状况下的CO2气体BL,发现
| BL |
| 22.4L/mol |
| Ag |
| 100g/mol |

实验一、定性探究:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生.
经检测,上述实验中产生的无色气体均为CO2.请回答:
(1)试解释可以在饱和氯水中加入石灰石制备HClO的原因______.
(2)写出步骤③中第一份及第二份滤液发生反应的离子方程式:
第一份:______.
第二份:______.
(3)试根据所学知识推测,在②的滤液中含 有的溶质,除了溶解的极少量氯气外,还含有的其它溶质为(写化学式)______.
实验二、定量探究:
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如右图所示装置(部分夹持、支撑仪器没有画出)实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加.请回答:
(4)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,水槽中的水应换为______.
A.饱和碳酸钠溶液 B.饱和碳酸氢钠溶液 C.饱和食盐水
(5)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少Ag,总共收集到标准状况下的CO2气体BL,发现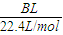 明显小于
明显小于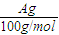 .若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是______.
.若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是______.
 查看习题详情和答案>>
查看习题详情和答案>>
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生.
经检测,上述实验中产生的无色气体均为CO2.请回答:
(1)试解释可以在饱和氯水中加入石灰石制备HClO的原因______.
(2)写出步骤③中第一份及第二份滤液发生反应的离子方程式:
第一份:______.
第二份:______.
(3)试根据所学知识推测,在②的滤液中含 有的溶质,除了溶解的极少量氯气外,还含有的其它溶质为(写化学式)______.
实验二、定量探究:
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如右图所示装置(部分夹持、支撑仪器没有画出)实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加.请回答:
(4)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,水槽中的水应换为______.
A.饱和碳酸钠溶液 B.饱和碳酸氢钠溶液 C.饱和食盐水
(5)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少Ag,总共收集到标准状况下的CO2气体BL,发现
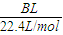 明显小于
明显小于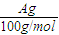 .若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是______.
.若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是______.
 查看习题详情和答案>>
查看习题详情和答案>>