网址:http://m.1010jiajiao.com/timu3_id_48398[举报]
(22分)在一固定容积的密闭容器中进行着如下反应:CO2(g) + H2(g) 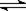 CO(g) + H2O(g) 其平衡常数K和温度t的关系如下:
CO(g) + H2O(g) 其平衡常数K和温度t的关系如下:
|
t℃ |
700 |
800 |
850 |
1000 |
1200 |
|
K |
2.6 |
1.7 |
1.0 |
0.9 |
0.6 |
(1) K的表达式为:________________________;
(2) 该反应的正反应为 _______反应(“吸热”或“放热”);
(3) 能判断该反应是否已经达到化学平衡状态的是: ________
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正 = v(H2O)逆 D.c(CO2) = c(CO)
(4) 在850℃时,可逆反应:CO2(g) + H2(g)
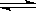 CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
|
时间/min |
CO2 (mol/L) |
H2 (mol/L) |
CO (mol/L) |
H2 O (mol/L) |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
c1 |
c2 |
c3 |
c3 |
|
4 |
c1 |
c2 |
c3 |
c3 |
①前2min,用CO2表示该化学反应的速率是________________________________;
②在3-4min之间,反应处于_____________状态(填“平衡”或“非平衡”)。
③计算:3min—4min达到平衡时CO的平衡浓度c3和CO2 (g)的转化率,要求写出计算过程(850℃时,K值从上表可查出;c3精确到小数点后面三位数)。
查看习题详情和答案>>
(22分)在一固定容积的密闭容器中进行着如下反应:CO2(g) + H2(g) CO(g) + H2O(g) 其平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1) K的表达式为:________________________;
(2) 该反应的正反应为 _______反应(“吸热”或“放热”);
(3) 能判断该反应是否已经达到化学平衡状态的是: ________
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正 = v(H2O)逆 D.c(CO2) = c(CO)
(4) 在850℃时,可逆反应:CO2(g) + H2(g) CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
| 时间/min | CO2 (mol/L) | H2 (mol/L) | CO (mol/L) | H2 O (mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
①前2min,用CO2表示该化学反应的速率是________________________________;
②在3-4min之间,反应处于_____________状态(填“平衡”或“非平衡”)。
③计算:3min—4min达到平衡时CO的平衡浓度c3和CO2 (g)的转化率,要求写出计算过程(850℃时,K值从上表可查出;c3精确到小数点后面三位数)。
查看习题详情和答案>>
(1)目前工业上利用CO2来生产燃料甲醇,可将CO2变废为宝.已知常温常压下:
①CH3OH(l)+O2(g)═CO(g)+2H2O(g)△H=-354.8kJ/mol
②2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol
则反应2CO2(g)+4H2O(g)═2CH3OH(l)+3O2(g)△H=______kJ?mol-1
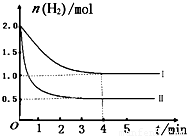
(2)T℃时,已知反应:CO2(g)+H2(g)?CO(g)+H2O(g)△H<0.在T℃下,将2mol CO2和2mol H2充入1L的密闭容器中,测得H2的物质的量随时间的变化情况如图中曲线I所示.
①按曲线I计算反应从0到4min时,υ(H2)=______.
②在T℃时,若仅改变某一外界条件时,测得H2的物质的量随时间的变化情况如图中曲线Ⅱ所示,则改变的外界条件为______.计算该反应按曲线II进行,达到平衡时,容器中c(CO2)=______.
(3)已知25℃时,乙酸和碳酸的电离平衡常数如下表:
| 物质的化学式 | CH3COOH | H2CO3 | |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 | K2=5.6×10-11 |
②在25℃时,在乙酸溶液中加入一定量的NaHCO3,保持温度不变,所得混合液的pH=6,那么混合液中
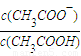 =______.
=______.③向0.1mol?L -1CH3COOH溶液中加入少量CH3COONa晶体,保持温度不变,下列有关说法正确的是______(填代号).
a.溶液的pH增大 b.CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH-)?c(H+)不变.
 查看习题详情和答案>>
查看习题详情和答案>>
73.2%和7.32%.
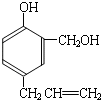
(1)A的分子式是
(2)已知:
ⅰ.
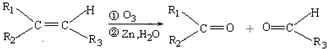 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)ⅱ.
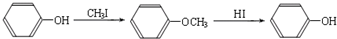
又知,A在一定条件下能发生如下转化,某些生成物(如H2O等)已略去.
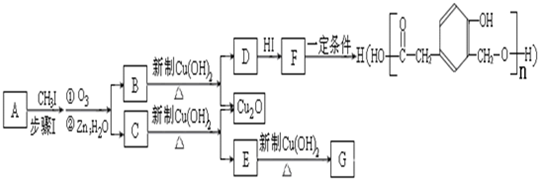
请回答:
①步骤Ⅰ的目的是
②若G为碳酸,则E的结构简式是
④F在一定条件下可发生酯化反应,生成M(M与FeCl3反应,溶液呈紫色;且分子结构中含有苯环和一个七元环)请写出该反应的化学方程式

⑤A的结构简式是



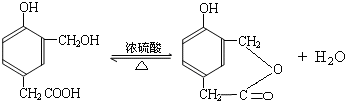
(3)已知A的某种同分异构体N具有如下性质:
①N与FeCl3反应,溶液呈紫色;
②N在一定条件下可发生银镜反应,N与H2在苯环侧链上按照物质的量之比1:1作用后的生成物不能发生消去反应;
③在通常情况下,1mol N能与含1mol Br2的浓溴水发生取代反应;
④N分子中苯环上的取代基上无支链.
请写出:N可能的结构简式


(4)请设计合理方案,完成从
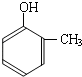 到的合成
到的合成 路线(用合成路线流程图表示,并注明反应条件).
路线(用合成路线流程图表示,并注明反应条件).提示:①;合成过程中无机试剂任选;②合成路线流程图示例如下:
CH3CH2OH
| 浓H2SO4 |
| 170℃ |
| 高温、高压 |
| 催化剂 |

2- 7 |
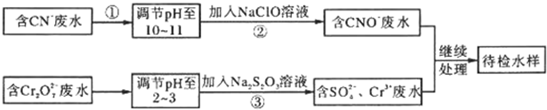
回答下列问题:
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为
(2)步骤③的反应为
| S2O | 2- 3 |
2- 7 |
| SO | 2- 4 |
2- 7 |
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是
(4)在25℃下,将a mol?L-1的NaCN溶液与0.01mol?L-1的盐酸等体积混合,反应后测得溶液pH=7,则a
(5)取工业废水水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量
Na2S溶液,蓝色沉淀转化成黑色沉淀.该过程中反应的离子方程是