网址:http://m.1010jiajiao.com/timu3_id_48380[举报]
| 高温 |
请回答下列问题:
(1)上述反应的化学平衡常数表达式为
| c3(H2O) |
| c3(H2) |
| c3(H2O) |
| c3(H2) |
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
| ||
| ||
(4)已知:温度过高时,WO2 (s)转变为WO2 (g);
WO2 (s)+2H2 (g)?W (s)+2H2O (g);△H=+66.0kJ?mol-1
WO2 (g)+2H2?W (s)+2H2O (g);△H=-137.9kJ?mol-1
则WO2 (s)?WO2 (g) 的△H=
(5)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:
W(s)+2I2 (g)
| ||
| 约3000℃ |
下列说法正确的有
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢.
WO3 (s)+3H2 (g)
| 高温 |
请回答下列问题:
(1)在一定温度下进行上述反应,若反应容器的容积为0.5L,2min后达到平衡,测得固体的质量减少了4.80g,则H2的平均反应速率
| c3(H2O) |
| c3(H2) |
| c3(H2O) |
| c3(H2) |
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为
(3)一定温度下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是
A.混合气体的总压强保持不变 B.v正(H20)=v正(H2)
C.混合气体的密度保持不变 D. 混合气体的平均式量保持不变
(4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s)+2I2 (g)
| 1400℃ |
| 约3000℃ |
A.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.灯管内的I2可循环使用.
| 高温 |
请回答下列问题:
(1)上述反应的化学平衡常数表达式为
| c3(H2O) |
| c3(H2) |
| c3(H2O) |
| c3(H2) |
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
(4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W(s)+2I2(g)
| 1400℃ |
| 约3000℃ |
A.灯管内的I2可循环使用
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢.
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:
WO3 (s) + 3H2
(g)  W (s) + 3H2O
(g)
W (s) + 3H2O
(g)
请回答下列问题:
⑴上述反应的化学平衡常数表达式为___________________________。
⑵某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为_____________________;随温度的升高,H2与水蒸气的体积比减小,则该反应为反应_____________________(填“吸热”或“放热”)。
⑶上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
|
温度 |
25℃ ~ 550℃ ~ 600℃ ~ 700℃ |
|
主要成份 |
WO3 W2O5 WO2 W |
第一阶段反应的化学方程式为___________________________;580℃时,固体物质的主要成分为________;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为____________________________________。
⑷ 已知:温度过高时,WO2 (s)转变为WO2 (g);
WO2 (s) + 2H2
(g)  W
(s) + 2H2O (g);ΔH = +66.0 kJ·mol-1
W
(s) + 2H2O (g);ΔH = +66.0 kJ·mol-1
WO2 (g) + 2H2(g)
 W
(s) + 2H2O (g);ΔH = -137.9 kJ·mol-1
W
(s) + 2H2O (g);ΔH = -137.9 kJ·mol-1
则WO2 (s)  WO2
(g) 的ΔH = ______________________。
WO2
(g) 的ΔH = ______________________。
⑸ 钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2
(g) 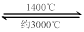 WI4
(g)。下列说法正确的有____________。
WI4
(g)。下列说法正确的有____________。
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
查看习题详情和答案>>
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:
WO3 (s) + 3H2 (g)  W
(s) + 3H2O (g) 请回答下列问题:
W
(s) + 3H2O (g) 请回答下列问题:
(1)在一定温度下进行上述反应,若反应容器的容积为0.5 L,2min后达到平衡,测得固体的质量减少了4.80 g,则H2的平均反应速率_________;该反应的平衡常数表达式K=___________
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为__________;随温度的升高,H2与水蒸气的体积比减小,则该反应为 ____ (填“吸热”或“放热”) 反应。
(3)一定温度下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是________。
A.混合气体的总压强保持不变 B.v正(H20)= v正(H2)
C.混合气体的密度保持不变 D.混合气体的平均式量保持不变
(4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g)  WI4
(g)。下列说法正确的有__________。
WI4
(g)。下列说法正确的有__________。
A.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.灯管内的I2可循环使用
查看习题详情和答案>>