摘要:22.某学习小组查找出热化学循环制氢法: 2H2O(l)+SO2(g)+I2(s)→ H2SO4 H2SO4(aq)→ H2O(l)+SO2(g)+1/2O2(g) 2HI(g)→ H2(g)+ I2(g) 从理论上讲.该循环中.1mol H2O能制得氢气( ) A.1mol B.2mol C.0.25mol D.0.5mol
网址:http://m.1010jiajiao.com/timu3_id_48149[举报]
(08茂名市二模)某学习小组查找出热化学循环制氢法:
2H2O(l)+SO2(g)+I2(s)→ H2SO4(aq)+ 2HI(g)
H2SO4(aq)→ H2O(l)+SO2(g)+1/2O2(g)
2HI(g)→ H2(g)+ I2(g)
从理论上讲,该循环中,1mol H2O能制得氢气()
A.1mol B.2mol C.0.25mol D.0.5mol
查看习题详情和答案>>某学习小组查找出热化学循环制氢法:
2H2O(l)+SO2(g)+I2(s)→ H2SO4(aq)+ 2HI(g)
H2SO4(aq)→ H2O(l)+SO2(g)+1/2O2(g)
2HI(g)→ H2(g)+ I2(g)
从理论上讲,该循环中,1mol H2O能制得氢气( )
A.1mol B.2mol C.0.25mol D.0.5mol
查看习题详情和答案>>
铝热反应常用于冶炼高熔点的金属,可简单认为是铝与某些金属氧化物在高温条件下发生的反应.某学习小组对铝热反应(以Al和Fe2O3反应为例)实验进行研究.查阅数据得到Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下表所示:
试回答下列问题:
(1)在铝热反应中金属铝表现出 性(填“氧化”或“还原”).请判断下列金属中那一个不能由铝热反应制取 .(填序号)
①Fe ②Cr(铬) ③V(钒) ④Ca ⑤Mn
(2)某同学推测,铝热反应所得到的熔融物中应含有铁、铝两种金属.如设计一个简单的实验方案证明该熔融物中含有金属铝,则实验所需用的试剂为 ,可观察到的实验现象是 .
(3)另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:
取一块该熔融物投入到少量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察溶液颜色未变血红色,即可证明熔融物中不含有Fe2O3.则
①物质甲是 (填化学式).
②该同学的实验方案是否合理? (填“合理”或“不合理”).理由: .
查看习题详情和答案>>
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1565 |
| 沸点/℃ | 2467 | 2980 | 2750 | … |
(1)在铝热反应中金属铝表现出
①Fe ②Cr(铬) ③V(钒) ④Ca ⑤Mn
(2)某同学推测,铝热反应所得到的熔融物中应含有铁、铝两种金属.如设计一个简单的实验方案证明该熔融物中含有金属铝,则实验所需用的试剂为
(3)另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:
取一块该熔融物投入到少量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察溶液颜色未变血红色,即可证明熔融物中不含有Fe2O3.则
①物质甲是
②该同学的实验方案是否合理?
(2013?沭阳县模拟)工业上常用铁质容器盛装冷浓硫酸.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是
(2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y.
①甲同学认为X中除Fe3+外还可能含有Fe2+.写出生成Fe2+所有可能的离子反应方程式:
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应的化学方程式为:
查看习题详情和答案>>
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是
铁表面被钝化
铁表面被钝化
.(2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y.
①甲同学认为X中除Fe3+外还可能含有Fe2+.写出生成Fe2+所有可能的离子反应方程式:
Fe+2H+=Fe2++H2↑; Fe+2Fe3+=3Fe2+
Fe+2H+=Fe2++H2↑; Fe+2Fe3+=3Fe2+
.若要确认其中有Fe2+,应选用d
d
(选填序号).a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应的化学方程式为:
SO2+Br2+2H2O=2HBr+H2SO4
SO2+Br2+2H2O=2HBr+H2SO4
.然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g.由于此推知气体Y中SO2的体积分数为66.7%
66.7%
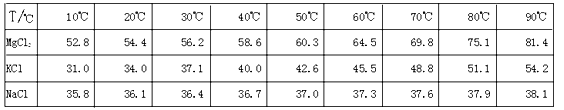
.广东省拥有丰富的海洋资源,盐化工是广东省的主要产业之一.从盐卤初步得到的光卤石(KCl?MgCl2?6H2O)晶体中,还含有约8%的NaCl.
为了从光卤石中提取KCl和MgCl2,某学习小组查阅资料得到MgCl2、KCl和NaCl在不同温度下的溶解度S(g/100g水)的数据如下:
并设计出下面的实验流程:
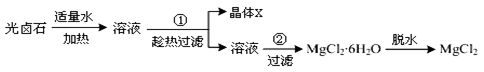
根据他们提供的数据和实验回答下列问题:
问题1:以上实验流程中晶体X的化学式为
问题2:工业上采用电解无水氯化镁的方法制取金属镁.
(1)若在空气中加热MgCl2?6H2O,生成的是Mg(OH)Cl,写出反应的化学方程式:
(2)该小组同学采取将浓硫酸滴入浓盐酸制取氯化氢气体的方法,用下图的实验装置,在干燥的HCl气流中加热MgCl2?6H2O来得到无水MgCl2.装置中盛有浓硫酸的仪器分别是
(3)为防止对环境的污染,还需要将尾气吸收,但实验室现有的仪器和试剂只有:烧杯、导管、蒸馏水、酒精、苯、四氯化碳.请你为他们设计一个尾气的吸收装置,将装置图画在方框内并在图中标明所用试剂.
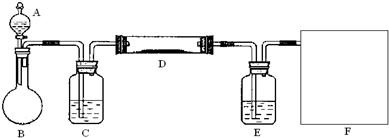
查看习题详情和答案>>
为了从光卤石中提取KCl和MgCl2,某学习小组查阅资料得到MgCl2、KCl和NaCl在不同温度下的溶解度S(g/100g水)的数据如下:

并设计出下面的实验流程:

根据他们提供的数据和实验回答下列问题:
问题1:以上实验流程中晶体X的化学式为
KCl
KCl
,若制得的X还含有少量的可溶性杂质,可用重结晶
重结晶
的方法进一步提纯.操作步骤①中为趁热过滤的原因是防止氯化镁析出
防止氯化镁析出
.问题2:工业上采用电解无水氯化镁的方法制取金属镁.
(1)若在空气中加热MgCl2?6H2O,生成的是Mg(OH)Cl,写出反应的化学方程式:
MgCl2?6H2O═Mg(OH)Cl+HCl↑+5H2O↑
MgCl2?6H2O═Mg(OH)Cl+HCl↑+5H2O↑
(2)该小组同学采取将浓硫酸滴入浓盐酸制取氯化氢气体的方法,用下图的实验装置,在干燥的HCl气流中加热MgCl2?6H2O来得到无水MgCl2.装置中盛有浓硫酸的仪器分别是
A、C、E
A、C、E
(填写仪器的符号),需要加热的仪器是D
D
(同上).(3)为防止对环境的污染,还需要将尾气吸收,但实验室现有的仪器和试剂只有:烧杯、导管、蒸馏水、酒精、苯、四氯化碳.请你为他们设计一个尾气的吸收装置,将装置图画在方框内并在图中标明所用试剂.
