摘要:所以HNO3在70-90S范围内的平均反应速率为 v(HNO3)=△c(HNO3)/t == 1/110 mol·L-1·S-1 (3)作图略 作图要点:因为实验①HNO3与大理石恰好完全反应, 实验②中.HNO3不足量.纵坐标对应的每一个值均为原来的1/2, 实验③④的图象类似.恰好完全反应.但反应条件改变.升高温度与大理石细颗粒增大表面积可加快反应速率.所以图象曲线斜率变大.平衡位置纵坐标与实验①相同.
网址:http://m.1010jiajiao.com/timu3_id_47609[举报]
某学生小组用HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验
HNO3的用量为25.0mL、大理石用量为10.00g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号
HNO3的用量为25.0mL、大理石用量为10.00g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号
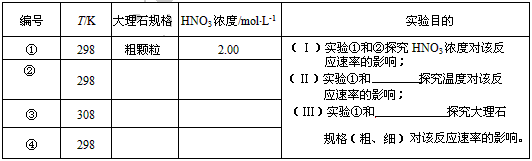
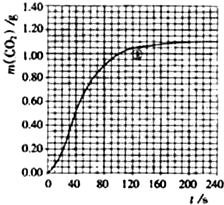
(2)实验①中CO2的物质的量随时间变化的关系见图: 计算在70-90s范围内HNO3的平均反应速率(忽略溶液体积变化,不需要写出计算过程)。
某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为
1.00 mol·L-1、2.00mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验
HNO3的用量为25.0mL、大理石用量为10.00g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号
1.00 mol·L-1、2.00mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验
HNO3的用量为25.0mL、大理石用量为10.00g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号
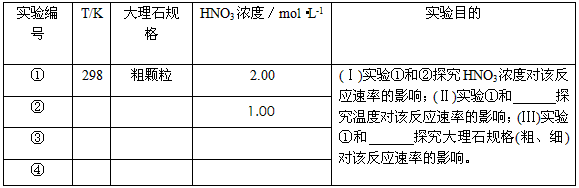
(2)实验①中CO2质量随时间变化的关系见下图
依据反应方程式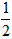 CaCO3+HNO3==
CaCO3+HNO3==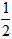 Ca(NO3)2+
Ca(NO3)2+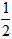 CO2↑+
CO2↑+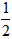 H2O,计算实验①在70~90s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。
H2O,计算实验①在70~90s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。
查看习题详情和答案>>
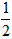 CaCO3+HNO3==
CaCO3+HNO3==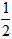 Ca(NO3)2+
Ca(NO3)2+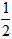 CO2↑+
CO2↑+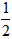 H2O,计算实验①在70~90s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。
H2O,计算实验①在70~90s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。某学生小组用HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308 K,每次实验HNO3的用量为25.00 mL、大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
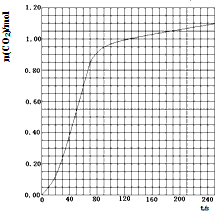
| 编号 | T/K | 大理石规格 | HNO3浓度 / mol·L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (I)实验①和②探究HNO3浓度对该反应速率的影响; |
| ② | 298 |
|
| (II)实验①和_________探究温度对该反应速率的影响; (Ⅲ)实验①和________探究大理石规格(粗、细)对该反应速率的影响。 |
| ③ | 308 |
|
| |
| ④ | 298 |
|
|
(2)实验①中CO2的物质的量随时间变化的关系见图:
计算在70—90s范围内HNO3的平均反应速率(忽略溶液体积变化)。
查看习题详情和答案>>
某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.所用HNO3浓度为1.00mol?L-1、2.00mol?L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3的用量为25.0mL、大理石用量为10.00g.
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
(2)实验①中CO2质量随时间变化的关系见下图:依据反应方程式
CaCO3+HNO3=
Ca(NO3)2+
CO2↑+
H2O,计算实验①在70-90s范围内HNO3的平均反应速率为(忽略溶液体积变化,) (图中70-90s间CO2的质量增加了0.1g)
(3)预期实验结果是(比较三组实验速率的快慢,用代号) 、 、 .
 查看习题详情和答案>>
查看习题详情和答案>>
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol?L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和 (Ⅲ)实验①和 |
| ② | ||||
| ③ | ||||
| ④ |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
(3)预期实验结果是(比较三组实验速率的快慢,用代号)
 查看习题详情和答案>>
查看习题详情和答案>>
某研究性学习小组用HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素.所用HNO3浓度为1.00mol?L-1、2.00mol?L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3的用量为25.0mL、大理石用量为10.00g.
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
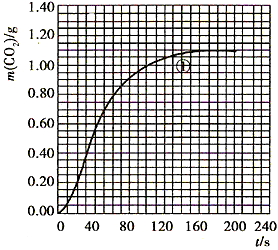
(2)实验①中CO2质量随时间变化的关系见图:
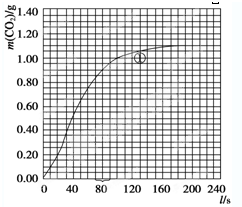
依据反应方程式
CaCO3+HNO3═
Ca(NO3)2+
CO2↑+
H2O,计算实验①在70-90s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程).
查看习题详情和答案>>
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol?L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和 ③ ③ 探究温度对该反应速率的影响;(Ⅲ)实验①和 ④ ④ 探究大理石规格(粗、细)对该反应速率的影响. |
| ② | ||||
| ③ | ||||
| ④ |

依据反应方程式
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |