摘要: 在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡: CH3COOH=CH3COO-+H+对于该平衡.下列叙述正确的是 A.加入水时.平衡向逆反应方向移动 B.0加入少量NaOH固体.平衡向正反应方向移动 C.加入少量0.1 mol·L-1 HCl溶液.溶液中c(H+) D.加入少量CH3COONa固体.平衡向正反应方向移动
网址:http://m.1010jiajiao.com/timu3_id_47206[举报]
在0.1 mol·L-1 Na2CO3溶液中,下列关系正确的是
A.c(Na+)=2c(CO![]() ) B.c(OH-)=2c(H+)
) B.c(OH-)=2c(H+)
C.c(HCO![]() )>c(H2CO3) D.c(Na+)<c(CO
)>c(H2CO3) D.c(Na+)<c(CO![]() )+c(HCO
)+c(HCO![]() )
)
在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH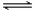 CH3COO-+ H+,对于该平衡,下列叙述正确的是( )
CH3COO-+ H+,对于该平衡,下列叙述正确的是( )
A.降温可以促进醋酸电离,会使氢离子浓度增大
B.加入少量0.1 mol·L-1HCl溶液,溶液中c(H+)不变
C.加入少量NaOH固体,平衡向正反应方向移动
D.加入少量CH3COONa固体,平衡向正反应方向移动
查看习题详情和答案>>
(平行班做)在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:
CH3COOH CH3COO-+H+ ,对于该平衡,下列叙述正确的是( )
CH3COO-+H+ ,对于该平衡,下列叙述正确的是( )
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)不变
D.加入少量CH3COONa固体,平衡向正反应方向移动
查看习题详情和答案>>