摘要:24.⑴S2- + H2OHS- +OH- HS- + H2OH2S +OH- ⑵2.7×10-3 ⑶172.5 ⑷使BaSO4得到充分的还原 ①②为吸热反应.炭和氧气反应放热维持反应所需高温
网址:http://m.1010jiajiao.com/timu3_id_47106[举报]
化学科研小组的同学在精确测试Na2SO3溶液的pH时,遇到了困惑.为此,他们进行了冷静的思考和准备,决心重新实验,揭开奥秘.请你了解情况,参与交流讨论.
[查阅资料]①常温下0.1mol?L-1的H2SO3溶液的pH约为2.1.
②通常情况下,H2S为无色,有腐蛋臭味的气体,其水溶液称为氢硫酸.常温下0.1mol?L-1的H2S溶液的pH约为4.5.
[实验操作]①准确称取纯净的Na2SO3?7H2O晶体25.20g,配成1L水溶液,测得其pH=7.8.
②以坩埚再次准确称取25.20g上述晶体,继而隔绝空气在600℃以上高温下强热至恒重,质量为12.60g.
③将②所得之12.60g固体进行元素定性定量分析,组成与Na2SO3无异.将其溶于水得250mL溶液,测得pH=10.3.
[分析猜想]Na2SO3?7H2O在强热下,失去结晶水,进而发生了分解反应(自身氧化还原反应)
[交流讨论]
(1)实验操作②中称量操作至少进行
(2)给Na2SO3?7H2O加热时要隔绝空气,请以简要的文字和化学方程式给以说明.
(3)猜想Na2SO3在高温强热下发生分解反应的化学方程式是
(4)实验①和③中,两次测得的溶液pH相差明显,其合理的解释是
(5)请你设计简单的实验方案,给上述分析、猜想及解释以佐证.请简单叙述实验步骤、现象和结论.
查看习题详情和答案>>
[查阅资料]①常温下0.1mol?L-1的H2SO3溶液的pH约为2.1.
②通常情况下,H2S为无色,有腐蛋臭味的气体,其水溶液称为氢硫酸.常温下0.1mol?L-1的H2S溶液的pH约为4.5.
[实验操作]①准确称取纯净的Na2SO3?7H2O晶体25.20g,配成1L水溶液,测得其pH=7.8.
②以坩埚再次准确称取25.20g上述晶体,继而隔绝空气在600℃以上高温下强热至恒重,质量为12.60g.
③将②所得之12.60g固体进行元素定性定量分析,组成与Na2SO3无异.将其溶于水得250mL溶液,测得pH=10.3.
[分析猜想]Na2SO3?7H2O在强热下,失去结晶水,进而发生了分解反应(自身氧化还原反应)
[交流讨论]
(1)实验操作②中称量操作至少进行
4
4
次.(2)给Na2SO3?7H2O加热时要隔绝空气,请以简要的文字和化学方程式给以说明.
避免Na2SO3被氧化,2Na2SO3+O2=2Na2SO4
避免Na2SO3被氧化,2Na2SO3+O2=2Na2SO4
.(3)猜想Na2SO3在高温强热下发生分解反应的化学方程式是
4Na2SO3
Na2S+3Na2SO4
| ||
4Na2SO3
Na2S+3Na2SO4
.
| ||
(4)实验①和③中,两次测得的溶液pH相差明显,其合理的解释是
实验③的溶液中可能有Na2S,相同条件下,S2-水解程度大于SO32-,溶液的碱性强
实验③的溶液中可能有Na2S,相同条件下,S2-水解程度大于SO32-,溶液的碱性强
.实验③中溶液的pH=10.3的原理是(以相关的离子方程式表示)S2-+H2O HS-+OH-
HS-+OH-
 HS-+OH-
HS-+OH-S2-+H2O HS-+OH-
HS-+OH-
. HS-+OH-
HS-+OH-(5)请你设计简单的实验方案,给上述分析、猜想及解释以佐证.请简单叙述实验步骤、现象和结论.
取③溶液适量于试管中,向其中加稀H2SO4,如有腐蛋气味气体生成,则证明有S2-
取③溶液适量于试管中,向其中加稀H2SO4,如有腐蛋气味气体生成,则证明有S2-
、另取③中溶液适量于试管中,加入HCl酸化的BaCl2,如有白色沉淀生成,证明有SO42-
另取③中溶液适量于试管中,加入HCl酸化的BaCl2,如有白色沉淀生成,证明有SO42-
.A、B、C、D、E、F为原子序数依次增大的六种元素,其中除F外均为短周期主族元素.常温下A、B、C的常见单质均为无色、无味的气体,D、E、F的单质均为固体,且F单质是目前世界上使用量最大的金属.A是所有元素中原子半径最小的元素,C与E同主族,且E的原子序数为C的2倍,D的最外层电子数比最内层多1个.请用化学用语回答下列问题:
(1)C的离子结构示意图为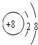
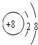 ;D与E两元素的离子半径:D
;D与E两元素的离子半径:D
(2)由A与碳元素组成的原子个数比3:1的最简化合物的结构简式为
(3)A与C形成的10电子阴离子与A与E形成的18电子阴离子反应的离子方程式为
(4)B的最高价氧化物的水化物与其氢化物反应生成的盐的水溶液的PH
(5)已知一定条件下,D单质与氧化物F3O4反应时,放出大量的热且使F单质熔化.试写出该反应的化学方程式
(6)上述元素中的五种元素可形成一种复盐,三种离子个数比为1:1:2,若向该盐溶液中逐滴加入浓NaOH溶液时,先产生白色沉淀,后沉淀逐渐溶解;同时有刺激性气味的气体放出;若加入盐酸酸化的BaCl2溶液,也有白色沉淀产生.则该复盐的化学式为
查看习题详情和答案>>
(1)C的离子结构示意图为
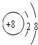
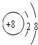
<
<
E(填“>”、“<”或“=”).(2)由A与碳元素组成的原子个数比3:1的最简化合物的结构简式为
CH3-CH3
CH3-CH3
.(3)A与C形成的10电子阴离子与A与E形成的18电子阴离子反应的离子方程式为
HS-+OH-=S2-+H2O
HS-+OH-=S2-+H2O
.(4)B的最高价氧化物的水化物与其氢化物反应生成的盐的水溶液的PH
<
<
7(填“>”、“<”或“=”).化合物AB3是一种无色的液态物质,受撞击会分解成两种单质,请写出该反应的化学方程式2HN3=H2↑+3N2↑
2HN3=H2↑+3N2↑
.(5)已知一定条件下,D单质与氧化物F3O4反应时,放出大量的热且使F单质熔化.试写出该反应的化学方程式
8Al+3Fe3O4
4Al2O3+9Fe
| ||
8Al+3Fe3O4
4Al2O3+9Fe
.
| ||
(6)上述元素中的五种元素可形成一种复盐,三种离子个数比为1:1:2,若向该盐溶液中逐滴加入浓NaOH溶液时,先产生白色沉淀,后沉淀逐渐溶解;同时有刺激性气味的气体放出;若加入盐酸酸化的BaCl2溶液,也有白色沉淀产生.则该复盐的化学式为
NH4Al(SO4)2
NH4Al(SO4)2
. 已知A、B、C、D四种物质分别是由短周期元素组成的微粒,它们之间有如图所示的转化关系,且A是一种含有18电子的微粒,C是一种含有10电子的微粒.请完成下列各题:
已知A、B、C、D四种物质分别是由短周期元素组成的微粒,它们之间有如图所示的转化关系,且A是一种含有18电子的微粒,C是一种含有10电子的微粒.请完成下列各题:(1)若A、D分别是两种气态单质分子,写出A与B反应的化学方程式:
2F2+2H2O=4HF+O2
2F2+2H2O=4HF+O2
;(2)若B是一种四核含18电子的分子,D是一种气态单质分子,则A的化学式为
N2H4
N2H4
,B的结构式为H-O-O-H
H-O-O-H
;(3)若A、B均是含2个原子的微粒,其中B中含有10个电子,D中含有l8个电子,则A、B之间发生反应的离子方程式为
HS-+OH-=S2-+H2O
HS-+OH-=S2-+H2O
;(4)若D是一种含有22个电子的分子,则符合如图所示关系的A的物质有
CH3OH、CH3-CH3
CH3OH、CH3-CH3
(写化学式,如果是有机物则写相应的结构简式).(1)Mg(OH)2中混有的Al(OH)3的杂质可以用NaOH除去,请用离子方程式表示
(2)Fe3+的检验用离子方程式表示
(3)在配制硫酸亚铁溶液时,常常加入铁粉,请说明原因
(4)硫化钠水溶液显
(5)写出镁条在二氧化碳中燃烧的化学方程式
查看习题详情和答案>>
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
(2)Fe3+的检验用离子方程式表示
Fe3++3SCN- Fe(SCN)3或Fe3++3OH-=Fe(OH)3
Fe(SCN)3或Fe3++3OH-=Fe(OH)3
 Fe(SCN)3或Fe3++3OH-=Fe(OH)3
Fe(SCN)3或Fe3++3OH-=Fe(OH)3Fe3++3SCN- Fe(SCN)3或Fe3++3OH-=Fe(OH)3
Fe(SCN)3或Fe3++3OH-=Fe(OH)3
 Fe(SCN)3或Fe3++3OH-=Fe(OH)3
Fe(SCN)3或Fe3++3OH-=Fe(OH)3(3)在配制硫酸亚铁溶液时,常常加入铁粉,请说明原因
2Fe3++Fe=3Fe2+
2Fe3++Fe=3Fe2+
(用离子方程式表示)(4)硫化钠水溶液显
碱
碱
性(填酸、碱、中),原因S2-+H2O HS-+OH-
HS-+OH-
 HS-+OH-
HS-+OH-S2-+H2O HS-+OH-
HS-+OH-
(用离子方程式表示) HS-+OH-
HS-+OH-(5)写出镁条在二氧化碳中燃烧的化学方程式
2Mg+CO2
2MgO+C
| ||
2Mg+CO2
2MgO+C
.
| ||
A、B、C、D、E五种短周期元素,原子序数依次递增.A原子形成的阳离子是一个质子,B原子的最外层电子数是次外层的2倍,C原子的最外层电子数与B原子的核外电子总数相等,D在同周期元素中原子半径最大,E与C是同主族元素.C、D两种元素可形成化合物甲,甲中既有离子键又有共价键;A、B、C、D四种元素可形成化合物乙,乙放入水中所得溶液显碱性.请回答:
(1)化合物甲的电子式为
(2)A、C、E可形成甲、乙两种微粒,它们均为负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为
(3)都由A、C、D、E形成的两种化合物可以相互反应,其离子方程式为
(4)气体A2、C2和A、C、D形成的离子化合物的水溶液可形成燃料电池,其负极的电极反应式为
查看习题详情和答案>>
(1)化合物甲的电子式为
Na+[ ]2-Na+
]2-Na+
 ]2-Na+
]2-Na+Na+[ ]2-Na+
]2-Na+
;乙的化学式有很多种,其中无机物是 ]2-Na+
]2-Na+NaHCO3
NaHCO3
.(2)A、C、E可形成甲、乙两种微粒,它们均为负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为
HS-+OH-=S2-+H2O
HS-+OH-=S2-+H2O
.(3)都由A、C、D、E形成的两种化合物可以相互反应,其离子方程式为
H++HSO3-═SO2↑+H2O
H++HSO3-═SO2↑+H2O
.(4)气体A2、C2和A、C、D形成的离子化合物的水溶液可形成燃料电池,其负极的电极反应式为
2H2-4e-+4OH-=4H2O
2H2-4e-+4OH-=4H2O
.