摘要:12.有 ① Na2CO3溶液 ② CH3COONa溶液 ③ NaOH溶液各25mL.物质的量浓度均为0.1mol·L-1.下列说法正确的是 A.3种溶液pH的大小顺序是 ③>②>① B.若将3种溶液稀释相同倍数.pH变化最大的是② C.若分别加入25mL0.1mol·L-1盐酸后.pH最大的是① D.若3种溶液的pH均为9.则物质的量浓度的大小顺序是③>①>②
网址:http://m.1010jiajiao.com/timu3_id_47017[举报]
(2010?潍坊一模)有①Na2CO3溶液②CH3COONa溶液 ③NaOH溶液 ④CH3COONH4溶液各25mL.物质的量浓度均为0.1mol?L-1,下列说法正确的是
( )
( )
查看习题详情和答案>>
(2010?朝阳区一模)工业上以氨气为原料制备硝酸的过程如图1所示:
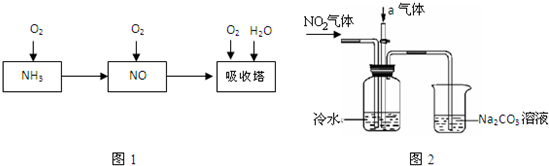
某课外小组模拟上述部分过程设计了如图2所示实验装置制备硝酸(所有橡胶制品均已被保护).
(1)工业上用氨气制取NO的化学方程式是
(2)连接好装置后,首先进行的操作是
(3)通入a气体的目的是
(4)盛有Na2CO3溶液的烧杯为尾气处理装置,该装置中发生反应的化学方程式是2NO2+Na2CO3═NaNO2+
(5)已知:温度低于21.15℃时,NO2几乎全部转变为N2O2.工业上可用N2O4与水反应来提高硝酸产率.N2O4与a气体在冷水中生成硝酸的化学方程式是
(6)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L.则2NO2(g)?N2O4(g)的平衡常数K=
.若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为
查看习题详情和答案>>

某课外小组模拟上述部分过程设计了如图2所示实验装置制备硝酸(所有橡胶制品均已被保护).
(1)工业上用氨气制取NO的化学方程式是
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
(2)连接好装置后,首先进行的操作是
检验装置的气密性
检验装置的气密性
.(3)通入a气体的目的是
提高NO2的转化率
提高NO2的转化率
.(4)盛有Na2CO3溶液的烧杯为尾气处理装置,该装置中发生反应的化学方程式是2NO2+Na2CO3═NaNO2+
NaNO3
NaNO3
+CO2
CO2
(5)已知:温度低于21.15℃时,NO2几乎全部转变为N2O2.工业上可用N2O4与水反应来提高硝酸产率.N2O4与a气体在冷水中生成硝酸的化学方程式是
2N2O4+O2+2H2O=4HNO3
2N2O4+O2+2H2O=4HNO3
.(6)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L.则2NO2(g)?N2O4(g)的平衡常数K=
| 1 |
| 2 |
| 1 |
| 2 |
50%
50%
. (2013?江苏)柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4?7H2O)通过下列反应制备:FeSO4+Na2CO3═FeCO3↓+Na2SO4 FeCO3+C6H8O7═FeC6H6O7+CO2↑+H2O 下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol?L-1计算).
(2013?江苏)柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4?7H2O)通过下列反应制备:FeSO4+Na2CO3═FeCO3↓+Na2SO4 FeCO3+C6H8O7═FeC6H6O7+CO2↑+H2O 下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol?L-1计算).| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
c
c
(填字母),原因是避免生成Fe(OH)2沉淀
避免生成Fe(OH)2沉淀
.a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是
取最后一次的洗涤滤液1~2 mL 于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净
取最后一次的洗涤滤液1~2 mL 于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净
.(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应.①铁粉的作用是
防止+2价的铁元素被氧化
防止+2价的铁元素被氧化
.②反应结束后,无需过滤,除去过量铁粉的方法是加入适量柠檬酸让铁粉反应完全
加入适量柠檬酸让铁粉反应完全
.(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体.分离过程中加入无水乙醇的目的是
降低柠檬酸亚铁在水中的溶解量,有利于晶体析出
降低柠檬酸亚铁在水中的溶解量,有利于晶体析出
.(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3) 出发,先制备绿矾,再合成柠檬酸亚铁.请结合如图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4?7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应,
“(过滤,)向反应液中加入足量的铁粉,充分搅拌后,滴加NaOH溶液调节反应液的pH约为5,过滤”
或“过滤,向滤液中滴加过量的NaOH溶液,过滤,充分洗涤固体,向固体中加入足量稀硫酸至固体完全溶解,再加入足量的铁粉,充分搅拌后,过滤”
或“过滤,向滤液中滴加过量的NaOH溶液,过滤,充分洗涤固体,向固体中加入足量稀硫酸至固体完全溶解,再加入足量的铁粉,充分搅拌后,过滤”
“(过滤,)向反应液中加入足量的铁粉,充分搅拌后,滴加NaOH溶液调节反应液的pH约为5,过滤”
或“过滤,向滤液中滴加过量的NaOH溶液,过滤,充分洗涤固体,向固体中加入足量稀硫酸至固体完全溶解,再加入足量的铁粉,充分搅拌后,过滤”
,得到FeSO4溶液,或“过滤,向滤液中滴加过量的NaOH溶液,过滤,充分洗涤固体,向固体中加入足量稀硫酸至固体完全溶解,再加入足量的铁粉,充分搅拌后,过滤”
(滴加稀硫酸酸化,)加热浓缩得到60℃饱和溶液,冷却至0℃结晶,过滤,少量冰水洗涤,低温干燥
(滴加稀硫酸酸化,)加热浓缩得到60℃饱和溶液,冷却至0℃结晶,过滤,少量冰水洗涤,低温干燥
,得到FeSO4?7H2O 晶体.有①Na2CO3溶液②CH3COONa溶液③NaOH溶液各25mL,物质的量浓度均为0.1mol?L-1.下列说法正确的是( )
| A、三种溶液的pH大小顺序是③>②>① | B、将三种溶液稀释相同倍数,pH变化最大的是① | C、若分别加入25 mL0.1 mol?L-1的盐酸后,溶液的pH大小顺序是①>③>② | D、三种溶液中,由水电离的c(OH-)大小顺序是③>①>② |