摘要:已知白色混合物粉末含有CuSO4.NaOH.Na2CO3.NaCl四种物质中的两种.实验方案如下: I.取适量固体混合物于烧杯中.加入蒸馏水搅拌.混合物完全溶解.得到无色透明溶液. II.为了进一步确定该固体混合物的组成.用胶头滴管取少量上述I溶液于试管中. 上述实验回答有关问题 (1)由I可以得到的结论是 . (2)由II可以得到的结论是 . (3)请写出试剂X的化学式 . 反应①的化学方程式为 . 反应②的化学方程式为 .
网址:http://m.1010jiajiao.com/timu3_id_4648[举报]
已知白色混合物粉末含有CuSO4、NaOH、Na2CO3、NaCl四种中的两种.为了确定其成分,进行如下实验:

Ⅰ取适量固体混合物于烧杯中,加入蒸馏水搅拌,混合物完全溶解,得到无色透明溶液.
Ⅱ为了进一步确定该固体混合物的组成,取少量上述1溶液于试管中.
依据上述实验回答相关问题:
(1)由Ⅰ可知原白色混合物粉末中没有
(2)由Ⅱ可知原白色混合物粉末中含有的两种物质是
(3)请写出试剂X的化学式
查看习题详情和答案>>

Ⅰ取适量固体混合物于烧杯中,加入蒸馏水搅拌,混合物完全溶解,得到无色透明溶液.
Ⅱ为了进一步确定该固体混合物的组成,取少量上述1溶液于试管中.
依据上述实验回答相关问题:
(1)由Ⅰ可知原白色混合物粉末中没有
硫酸铜
硫酸铜
.(2)由Ⅱ可知原白色混合物粉末中含有的两种物质是
碳酸钠、氢氧化钠或氯化钠
碳酸钠、氢氧化钠或氯化钠
.(3)请写出试剂X的化学式
HCl
HCl
.
已知白色混合物粉末含有CuSO4、NaOH、Na2CO3、NaCl四种中的两种.为了确定其成分,进行如下实验:

Ⅰ取适量固体混合物于烧杯中,加入蒸馏水搅拌,混合物完全溶解,得到无色透明溶液.
Ⅱ为了进一步确定该固体混合物的组成,取少量上述1溶液于试管中.
依据上述实验回答相关问题:
(1)由Ⅰ可知原白色混合物粉末中没有 .
(2)由Ⅱ可知原白色混合物粉末中含有的两种物质是 .
(3)请写出试剂X的化学式 . 查看习题详情和答案>>

Ⅰ取适量固体混合物于烧杯中,加入蒸馏水搅拌,混合物完全溶解,得到无色透明溶液.
Ⅱ为了进一步确定该固体混合物的组成,取少量上述1溶液于试管中.
依据上述实验回答相关问题:
(1)由Ⅰ可知原白色混合物粉末中没有 .
(2)由Ⅱ可知原白色混合物粉末中含有的两种物质是 .
(3)请写出试剂X的化学式 . 查看习题详情和答案>>
(2009?河西区二模)“过氧化钠(Na2O2)”是一种淡黄色固体,能与水或二氧化碳反应都能放出氧气.实验室有一份放置了较长时间的过氧化钠粉末,已发生了部分变质,小明想知道其中的成分,进行了如下实验.
[问 题]变质的过氧化钠粉末中有哪些成分?
[查阅资料]2Na2O2+2H2O═4NaOH+O2↑2Na2O2+2CO2═2Na2CO3+O2
[设 想]
设想一:部分变质的过氧化钠粉末是Na2O2和NaOH的混合物;
设想二:部分变质的过氧化钠粉末是
设想三:部分变质的过氧化钠粉末是Na2O2、NaOH和Na2CO3的混合物.
[实验过程]
[结 论]
(1)H2O2、Na2O2是一类特殊的氧化物,与H2O、CO2、Na2O等常见的氧化物想比较,氧元素的化合价不同.试推断H2O2与Na2O2中氧元素的化合价均为
(2)如果小明从第③步实验中就得到变质的过氧化钠粉末中含有NaOH,你肯定会提出质疑的,请说明原因:
(3)写出小明第②、③步实验中发生反应的化学方程式:
查看习题详情和答案>>
[问 题]变质的过氧化钠粉末中有哪些成分?
[查阅资料]2Na2O2+2H2O═4NaOH+O2↑2Na2O2+2CO2═2Na2CO3+O2
[设 想]
设想一:部分变质的过氧化钠粉末是Na2O2和NaOH的混合物;
设想二:部分变质的过氧化钠粉末是
Na2O2和Na2CO3(或NaOH和Na2CO3)
Na2O2和Na2CO3(或NaOH和Na2CO3)
的混合物;设想三:部分变质的过氧化钠粉末是Na2O2、NaOH和Na2CO3的混合物.
[实验过程]
| 实验操作 | 实验现象 | 实验结论 |
| ①取一定量变质的过氧化钠粉末一支试管里,加入过量的水,然后用 带火星的木条 带火星的木条 检验该生成的气体. |
木条复燃 木条复燃 |
证明粉末中有Na2O2. |
| ②在①的剩余的溶液中加入足量的硝酸钡溶液,充分反应. | 产生白色沉淀 | 证明粉末中有 碳酸钠 碳酸钠 . |
| ③在①的剩余的溶液中加入足量的硫酸铜溶液. | 产生蓝色沉淀 产生蓝色沉淀 |
(1)H2O2、Na2O2是一类特殊的氧化物,与H2O、CO2、Na2O等常见的氧化物想比较,氧元素的化合价不同.试推断H2O2与Na2O2中氧元素的化合价均为
-1
-1
.(2)如果小明从第③步实验中就得到变质的过氧化钠粉末中含有NaOH,你肯定会提出质疑的,请说明原因:
第①步反应中Na2O2与水反应也生成了NaOH,不能证明原变质粉末中是否含有NaOH
第①步反应中Na2O2与水反应也生成了NaOH,不能证明原变质粉末中是否含有NaOH
.(3)写出小明第②、③步实验中发生反应的化学方程式:
Na2CO3+Ba(OH)2=BaCO3↓+2NaOH
Na2CO3+Ba(OH)2=BaCO3↓+2NaOH
;2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
.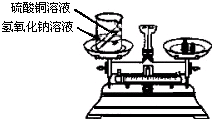 26、在学习了质量守恒定律后,小明和小华来到实验室,他们用如图所示的实验装置,验证了氢氧化钠溶液和硫酸铜溶液反应是符合质量守恒定律的.
26、在学习了质量守恒定律后,小明和小华来到实验室,他们用如图所示的实验装置,验证了氢氧化钠溶液和硫酸铜溶液反应是符合质量守恒定律的.(1)请写出该反应的化学方程式
2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
;(2)实验结束后,在整理仪器时小明发现,原来氢氧化钠溶液是放在敞口容器中.于是他们对刚刚完成的实验产生了疑问:
[提出问题]①氢氧化钠是否变质;
②如果氢氧化钠溶液已经变质,“变质”的氢氧化钠溶液与硫酸铜溶液反应为什么仍然符合质量守恒定律.
[查找资料]部分铜盐的溶解性表(20℃)
| 阳离子阴离子 | SO42- | NO3- | PO43- | Cl- | CO32- |
| Cu2+ | 溶 | 溶 | 不 | 溶 | 不 |
他们依据所学知识,对氢氧化钠样品溶液的溶质成分作了如下猜想:
[猜想]①可能是NaOH; ②可能是Na2CO3; ③可能是NaOH与Na2CO3的混合物.
[设计实验]Ⅰ取少量样品溶液,滴加稀盐酸,有气体生成.由此认为猜想②正确.请判断此结论是否正确,并简述理由.
不正确,混有碳酸钠的氢氧化钠也能和盐酸反应产生气体
.Ⅱ取少量样品溶液,滴加酚酞试液,溶液变为红色.由此认为猜想①正确.请判断此结论是否正确,并简述理由.
不正确,碳酸钠溶液也显碱性,能使无色的酚酞变红色
.Ⅲ取少量样品溶液,滴加BaCl2试液,有白色沉淀产生.由此判断白色粉末中含有
碳酸钠
.为了验证猜想③,继续向溶液中滴加BaCl2试液至不再产生沉淀,然后过滤.接下来还应进行的实验是滴加无色的酚酞试液
,若观察到溶液变红色
现象,则猜想③正确.[解释与分析]①假如氢氧化钠已变质.
②“变质”的氢氧化钠溶液与硫酸铜溶液反应,为什么仍然符合质量守恒定律:
碳酸钠溶液与硫酸铜溶液,反应过程中没有气体逸出
.