网址:http://m.1010jiajiao.com/timu3_id_45570[举报]
| |||||||||||
铜及其合金是人类最早使用的金属材料。
(1)金属铜采取下列哪种方式堆积( )

(2)在1个Cu2O晶胞中(结构如上图所示),Cu原子配位数为__________。
(3)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下:
①胆矾的化学式用配合物的形式表示为____________。
②胆矾中SO42—的空间构型为________,H2O中O原子的杂化类型为________。
③某兴趣小组称取2.500 g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如图所示的实验结果示意图。下列说法正确的是( )
| A.晶体从常温升到105 ℃的过程中只有氢键断裂 |
| B.胆矾晶体中形成配位键的4个水分子同时失去 |
| C.120 ℃时,剩余固体的化学式是CuSO4·H2O |
| D.按胆矾晶体失水时所克服的作用力大小不同,晶体中的水分子可以分为3种 |
铜及其合金是人类最早使用的金属材料。
(1)金属铜采取下列哪种方式堆积( )
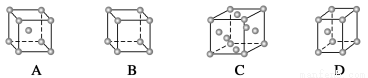
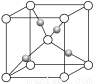
(2)在1个Cu2O晶胞中(结构如上图所示),Cu原子配位数为__________。
(3)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下:
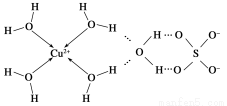
①胆矾的化学式用配合物的形式表示为____________。
②胆矾中SO42—的空间构型为________,H2O中O原子的杂化类型为________。
③某兴趣小组称取2.500 g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如图所示的实验结果示意图。下列说法正确的是( )
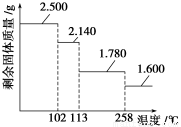
A.晶体从常温升到105 ℃的过程中只有氢键断裂
B.胆矾晶体中形成配位键的4个水分子同时失去
C.120 ℃时,剩余固体的化学式是CuSO4·H2O
D.按胆矾晶体失水时所克服的作用力大小不同,晶体中的水分子可以分为3种
查看习题详情和答案>>
(1)金属铜采取下列哪种方式堆积( )

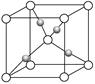
(2)在1个Cu2O晶胞中(结构如上图所示),Cu原子配位数为__________。
(3)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下:

①胆矾的化学式用配合物的形式表示为____________。
②胆矾中SO42—的空间构型为________,H2O中O原子的杂化类型为________。
③某兴趣小组称取2.500 g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如图所示的实验结果示意图。下列说法正确的是( )

| A.晶体从常温升到105 ℃的过程中只有氢键断裂 |
| B.胆矾晶体中形成配位键的4个水分子同时失去 |
| C.120 ℃时,剩余固体的化学式是CuSO4·H2O |
| D.按胆矾晶体失水时所克服的作用力大小不同,晶体中的水分子可以分为3种 |
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某化学兴趣小组将一批废弃的线路板简单处理后,得到主要含Cu、Al及少量Fc、Au、Pt等金属的混合物,设计了如下制备硫酸铜晶体和硫酸铝晶体的路线:

部分阳离子以氢氧化物形式沉淀时溶液的pH见下表
|
沉淀物 |
Fe( OH)2 |
Fe( OH)3 |
Al( OH)3 |
Cu( OH)2 |
|
开始沉淀 |
5.8 |
1.1 |
4.0 |
5.4 |
|
完全沉淀 |
8.8 |
3.2 |
5.2 |
6.7 |
请回答下列问题:
(1)第①步操作前需将金属混合物进行粉碎,其目的是 ;
(2)某学生认为用H2O2代替浓HNO3更好,理由是 ;
请写出Cu溶于H2O2与稀硫酸混合溶液的离子方程式是 。
(3)第②步中应将溶液pH调至 。
(4)由滤渣2制取Al2( SO4)3.18H2O,探究小组设计了两种方案:

你认为 种方案为最佳方案,理由是 、 。
(5)为了测定硫酸铜晶体的纯度,某同学准确称取4.0g样品溶于水配成l00mL溶液,取l0m溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.l000mol·L-1Na2S2O3标准溶液滴定至终点,共消耗14. 00mL Na2S2O3标准溶液。上述过程中反应的离子方程式如下:
2Cu2+ +4I-=2CuI(白色)↓+I2
2S2O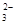 +I2=
2I-+S4O
+I2=
2I-+S4O
①样品中硫酸铜晶体的质量分数为____ 。
②另一位同学提出通过测定样品中硫酸根离子的量也可求得硫酸铜晶体的纯度,其他同学认为此方案不可行,理由是 。
查看习题详情和答案>>