摘要: Ⅰ.(1)化学方程式是 (1)4HNO3(浓) 4NO2↑+O2↑+2H2O (2)不正确.理由是带火星的木条熄灭可能是由于加热时产生大量水蒸气. Ⅱ.(1)该反应的化学方程式是2Cu(NO3)2 2CuO+4NO2↑+O2↑ (2)正确 .理由是硝酸铜分解产生的混合气体中氧气的体积分数与空气中氧气的体积分数基本相同.若NO2不支持燃烧.则木条不会复燃. III.用金属铜与浓硝酸反应制取NO2气体.并用浓硫酸或无水氯化钙进行干燥.再将带火星的木条伸入二氧化氮中观察现象.
网址:http://m.1010jiajiao.com/timu3_id_45200[举报]
(2010?天津一模)某研究性学习小组的一个课题是“NO2能否支持木条的燃烧?”由于实验室中没有现成的NO2气体,该小组的同学设计了两个方案(忽略N2O4的存在,图中铁架台等夹持仪器均已略去):
Ⅰ.实验装置如图1所示
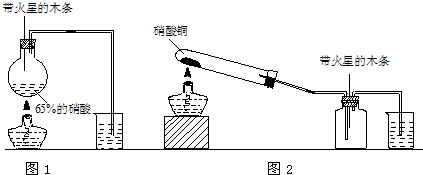
(1)浓硝酸受热分解的化学方程式是
(2)实验开始后木条上的火星逐渐熄灭,有的同学得出“NO2不能支持木条的燃烧”的结论.你认为这一结论是否正确?
Ⅱ.实验装置如图2所示
(1)硝酸铜固体加热分解的产物有氧化铜、二氧化氮和氧气,该反应的化学方程式是
(2)当集气瓶中充满红棕色气体时,木条复燃了,有的同学得出“NO2能支持木条的燃烧”的结论.你认为这一结论是否正确?
Ⅲ.为了更直接说明“NO2能否支持木条的燃烧”这一问题,请你重新设计一个简单的实验方案,简述实验原理和主要操作.
查看习题详情和答案>>
Ⅰ.实验装置如图1所示

(1)浓硝酸受热分解的化学方程式是
4HNO3(浓)
4NO2↑+O2↑+2H2O
| ||
4HNO3(浓)
4NO2↑+O2↑+2H2O
.
| ||
(2)实验开始后木条上的火星逐渐熄灭,有的同学得出“NO2不能支持木条的燃烧”的结论.你认为这一结论是否正确?
不正确
不正确
(填“正确”或“不正确),理由是带火星的木条熄灭可能是由于加热时产生大量水蒸气.
带火星的木条熄灭可能是由于加热时产生大量水蒸气.
.Ⅱ.实验装置如图2所示
(1)硝酸铜固体加热分解的产物有氧化铜、二氧化氮和氧气,该反应的化学方程式是
2Cu(NO3)2
2CuO+4NO2↑+O2↑
| ||
2Cu(NO3)2
2CuO+4NO2↑+O2↑
.
| ||
(2)当集气瓶中充满红棕色气体时,木条复燃了,有的同学得出“NO2能支持木条的燃烧”的结论.你认为这一结论是否正确?
正确
正确
(填“正确”或“不正确”),理由是理由是硝酸铜分解产生的混合气体中氧气的体积分数与空气中氧气的体积分数基本相同,若NO2不支持燃烧,则木条不会复燃.
理由是硝酸铜分解产生的混合气体中氧气的体积分数与空气中氧气的体积分数基本相同,若NO2不支持燃烧,则木条不会复燃.
.Ⅲ.为了更直接说明“NO2能否支持木条的燃烧”这一问题,请你重新设计一个简单的实验方案,简述实验原理和主要操作.
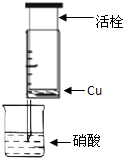 某研究性学习小组设计不同实验方案来研究硝酸的性质.
某研究性学习小组设计不同实验方案来研究硝酸的性质.(1)甲组同学设计如图装置来证实稀硝酸与铜反应,步骤如下.
A、检验50ml针筒的气密性.
B、抽出活栓,往针筒内放入一小块铜片,把针筒活栓推到底,将针筒下端玻璃管浸入蒸馏水中,抽拉活栓,吸入约10mL蒸馏水,发现针筒内仍有空气,然后
针头朝上倒放
针头朝上倒放
.C、将针筒下端玻璃管浸入浓硝酸中,抽拉活栓,缓缓吸入4mL浓硝酸,将针筒下端套上橡皮管,然后用铁夹夹住.
回答以下相关问题:
①B中应补充的操作是
推活栓,使针头内充满水
推活栓,使针头内充满水
.②一段时间后在针筒内观察到溶液颜色为蓝色,有
无色
无色
色气体产生.该反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
.③反应停止后,针筒内产生了气体,要验证产生的气体是NO,还需进一步进行的操作是
往针筒内抽气,气体由无色变红棕色
往针筒内抽气,气体由无色变红棕色
.(2)乙组同学也用此装置直接抽取浓硝酸和铜反应,发现溶液是绿色的,为了探究绿色的原因,乙组同学又做了三组对比实验,具体如下:
| 组 | m(Cu)/g | 硝酸(过量) | 溶液颜色 |
| A | 1 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| B | 0.5 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| C | 2 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 |
①一种观点认为:这可能是Cu2+浓度差异的结果,你同意这种看法吗?(填“同意”或“不同意”)
不同意
不同意
,原因是相同质量的铜与相同体积且过量的硝酸反应生成的铜离子浓度相同
相同质量的铜与相同体积且过量的硝酸反应生成的铜离子浓度相同
.(结合表格信息加以阐述)②另一种观点认为:溶液呈绿色是铜与浓硝酸反应时产生的NO2溶于过量浓硝酸显黄色,加上和蓝色的硝酸铜溶液混在一起,使溶液呈绿色.为了验证推断是否正确,三位同学分别设计了三种方案,并进行验证:
方案一:将绿色溶液转移至试管,并给试管加热片刻,立即看到大量红棕色气体产生.认为该气体一定是溶解在溶液中的NO2,但也有同学持有异议.请分析原因
过量的硝酸分解会产生红棕色的NO2
过量的硝酸分解会产生红棕色的NO2
.方案二:用双氧水和二氧化锰制得氧气,并把氧气缓缓通入绿色溶液中,观察溶液颜色变为蓝色.请用方程式表示溶液颜色变化的反应原理
4NO2+O2+2H2O=4HNO3
4NO2+O2+2H2O=4HNO3
.方案三:往蓝色溶液中缓缓通入NO2气体,溶液颜色变绿色.
③从环保的角度看,你认为三个方案中最好的是哪一个
方案二
方案二
.