摘要:.⑴如果是亚铁离子干扰.不可能变红之后.一段时间之后变成蓝色 ⑵ ⑶ ⑷比较硫氰根离子与氯离子.溴离子.碘离子的还原性强弱 ⑸a.加入氧化剂如氯气等必须少量 b.不一定 22 ⑴只要写出下列4个离子方程式中的任意一个.即可. HCO-3+OH- CO2-3+H2O,Ca2++CO32-+OH- CaCO3↓+H2O, Ca2++2HCO-3+2OH- CaCO3↓+CO32-+2H2O, Mg2++2OH- Mg(OH)2↓ ⑵③,Fe(OH)3 ⑶除去钙离子,调节溶液酸度 ⑷杀菌消毒或氧化性 ⑸①
网址:http://m.1010jiajiao.com/timu3_id_45198[举报]
下表是元素周期表的一部分.表中所列的字母分别代表某一种化学元素.

(1)X原子的价电子排布式是:
(2)M元素在周期表中的位置是第
(3)Q、R、M的第一电离能由大到小的顺序是
(4)E与Q所形成的化合物含
(5)Fe2+与Mn2+两种离子,
(6)用氢键表示式写出W的氢化物溶液中存在的所有氢键
查看习题详情和答案>>

(1)X原子的价电子排布式是:
3d104s1
3d104s1
;(2)M元素在周期表中的位置是第
二
二
周期第ⅥA
ⅥA
族;(3)Q、R、M的第一电离能由大到小的顺序是
N>O>C
N>O>C
(用元素符号表示);(4)E与Q所形成的化合物含
极性
极性
键,属非极性
非极性
分子.(填“极性”或“非极性”)(5)Fe2+与Mn2+两种离子,
Fe2+
Fe2+
更容易再失去1个电子,原因是亚铁离子的价电子式为3d6,锰离子的价电子式为3d5,d轨道处于半充满状态更稳定,而亚铁离子需要失去一个电子才达到半充满稳定状态,所以亚铁离子更容易再失去1个电子
亚铁离子的价电子式为3d6,锰离子的价电子式为3d5,d轨道处于半充满状态更稳定,而亚铁离子需要失去一个电子才达到半充满稳定状态,所以亚铁离子更容易再失去1个电子
.(6)用氢键表示式写出W的氢化物溶液中存在的所有氢键
F-H…F、F-H…O、O-F…F、O-H…O
F-H…F、F-H…O、O-F…F、O-H…O
.(2013?广东)大气中的部分碘源于O3对海水中I-的氧化.将O3持续通入NaI溶液中进行模拟研究.
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g)=IO-(aq)+O2(g)△H1
②IO-(aq)+H+(aq)?HOI(aq)△H2
③HOI(aq)+I-(aq)+H+(aq)?I2(aq)+H2O(l)△H3
总反应的化学方程式为
(2)在溶液中存在化学平衡:I2(aq)+I-(aq)?I3-(aq),其平衡常数表达式为
 .
.
(3)为探究Fe2+对O3氧化I-反应的影响(反应体系如图1),某研究小组测定两组实验中I3-浓度和体系pH,结果见图2和下表.
第1组实验中,导致反应后pH升高的原因是
②图1中的A为
③第2组实验进行18s后,I3-浓度下降.导致下降的直接原因有(双选)
A.c(H+)减小 B.c(I-)减小 C.I2(g)不断生成 D.c(Fe3+)增加
(4)据图2,计算3-18s内第2组实验中生成I3-的平均反应速率(写出计算过程,结果保留两位有效数字).
查看习题详情和答案>>
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g)=IO-(aq)+O2(g)△H1
②IO-(aq)+H+(aq)?HOI(aq)△H2
③HOI(aq)+I-(aq)+H+(aq)?I2(aq)+H2O(l)△H3
总反应的化学方程式为
2I-+O3+2H+ I2+O2+H2O
I2+O2+H2O
 I2+O2+H2O
I2+O2+H2O2I-+O3+2H+ I2+O2+H2O
I2+O2+H2O
,其反应△H= I2+O2+H2O
I2+O2+H2O△H1+△H2+△H3
△H1+△H2+△H3
(2)在溶液中存在化学平衡:I2(aq)+I-(aq)?I3-(aq),其平衡常数表达式为


(3)为探究Fe2+对O3氧化I-反应的影响(反应体系如图1),某研究小组测定两组实验中I3-浓度和体系pH,结果见图2和下表.

| 编号 | 反应物 | 反应前pH | 反应后pH |
| 第1组 | O3+I- | 5.2 | 11.0 |
| 第2组 | O3+I-+Fe2- | 5.2 | 4.1 |
由2I-+O3+2H+ I2+O2+H2O可知消耗酸,所以pH升高
I2+O2+H2O可知消耗酸,所以pH升高
 I2+O2+H2O可知消耗酸,所以pH升高
I2+O2+H2O可知消耗酸,所以pH升高由2I-+O3+2H+ I2+O2+H2O可知消耗酸,所以pH升高
I2+O2+H2O可知消耗酸,所以pH升高
. I2+O2+H2O可知消耗酸,所以pH升高
I2+O2+H2O可知消耗酸,所以pH升高②图1中的A为
Fe2+
Fe2+
,由Fe3+生成A的过程能显著提高Ⅰ-的转化率,原因是O3可以将Fe2+氧化为Fe3+:O3+2Fe2++2H+=2Fe3++O2+H2O,Fe3+氧化I-:2Fe3++2I-=I2+2Fe2+,即A是亚铁离子,I-消耗量增大,转化率增大.
O3可以将Fe2+氧化为Fe3+:O3+2Fe2++2H+=2Fe3++O2+H2O,Fe3+氧化I-:2Fe3++2I-=I2+2Fe2+,即A是亚铁离子,I-消耗量增大,转化率增大.
.③第2组实验进行18s后,I3-浓度下降.导致下降的直接原因有(双选)
BC
BC
.A.c(H+)减小 B.c(I-)减小 C.I2(g)不断生成 D.c(Fe3+)增加
(4)据图2,计算3-18s内第2组实验中生成I3-的平均反应速率(写出计算过程,结果保留两位有效数字).
A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,X、Y是生活中常见的金属单质,相关物质间的关系如下图所示.

请回答下列问题:
(1)写出X与A反应的化学方程式:
(2)若试剂1是NaOH溶液,写出X与试剂1反应的离子方程式
(3)若试剂1和试剂2均是稀硫酸.
①检验物质D的溶液中金属离子的方法是
②将物质C溶于水,其溶液呈酸性,原因是
③某高效净水剂是由Y(OH)SO4聚合得到的.工业上以D、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是
(4)若试剂1和试剂2均是稀盐酸,将C与D混合后,通入气体Z,再滴加氢氧化钠溶液调节溶液的pH,可水解聚合得到高效净水剂聚合氯化铝铁[AlFe(OH)nCl6-n]m.气体Z是
查看习题详情和答案>>

请回答下列问题:
(1)写出X与A反应的化学方程式:
3FeO+2Al
Al2O3+3Fe
| ||
3FeO+2Al
Al2O3+3Fe
.
| ||
(2)若试剂1是NaOH溶液,写出X与试剂1反应的离子方程式
2Al+2H2O+2OH-═2AlO2-+3H2↑
2Al+2H2O+2OH-═2AlO2-+3H2↑
.(3)若试剂1和试剂2均是稀硫酸.
①检验物质D的溶液中金属离子的方法是
取少量溶液于试管中,滴加几滴KSCN溶液不变色,滴加氯水后溶液变红色,则证明原溶液中含有Fe2+
取少量溶液于试管中,滴加几滴KSCN溶液不变色,滴加氯水后溶液变红色,则证明原溶液中含有Fe2+
.②将物质C溶于水,其溶液呈酸性,原因是
Al3++3H2O  Al(OH)3+3H+
Al(OH)3+3H+
 Al(OH)3+3H+
Al(OH)3+3H+Al3++3H2O  Al(OH)3+3H+
Al(OH)3+3H+
(用离子方程式表示). Al(OH)3+3H+
Al(OH)3+3H+③某高效净水剂是由Y(OH)SO4聚合得到的.工业上以D、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是
2FeSO4+2NaNO2+H2SO4═2Fe(OH)SO4+Na2SO4+2NO↑
2FeSO4+2NaNO2+H2SO4═2Fe(OH)SO4+Na2SO4+2NO↑
.(4)若试剂1和试剂2均是稀盐酸,将C与D混合后,通入气体Z,再滴加氢氧化钠溶液调节溶液的pH,可水解聚合得到高效净水剂聚合氯化铝铁[AlFe(OH)nCl6-n]m.气体Z是
氯气
氯气
,其作用是亚铁离子氧化为铁离子
亚铁离子氧化为铁离子
.设NA为阿伏加德罗常数,下列叙述中正确的是( )
A.0.3mol NO2气体溶于足量水中充分反应转移的电子总数为0.2 NA
B.7.8g Na2O2固体中含有的离子总数为0.4NA
C.标准状况下,22.4L SO3与足量水充分反应生成的H+的总数为2NA
D.0.5mol Fe与过量的硫在加热的条件下充分反应得到的电子总数为1.5NA
【解析】NO2气体溶于的方程式为3NO2+H2O=2HNO3+NO在反应中NO2既是氧化剂还是还原剂,转移的电子数是2,所以A正确。过氧化钠中阳离子和阴离子的个数之比是2︰1,所以7.8g Na2O2固体中含有的离子总数为0.3NA,即B不正确。标准状况下三氧化硫不是气体,C不正确。铁与稀硫酸反应生成的是亚铁离子,即0.5mol Fe失去的电子是1mol,D不正确。答案选A。
查看习题详情和答案>>
下列离子方程式中书写正确的是( )
A. 向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:
Ba2++OH-+H++SO42-= BaSO4↓+H2O
B. NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-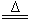 NH3↑+H2O
NH3↑+H2O
C. 稀硝酸和过量的铁屑反应:3 Fe+8H++2 NO3-= 3 Fe3++2 NO↑+4 H2O
D. KI溶液与H2SO4酸化的H2O2溶液混合:2 I-+H2O2+2 H+=2 H2O+I2
【解析】A中没有配平,正确是Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O。B中还有碳酸钾生成,C中铁过量,生成物应是亚铁离子,所以正确的答案是D。
查看习题详情和答案>>