摘要:17.(1)①A.B.C ②NaA1O2[或NaA1(OH)4].NaSiO3 ③除去A1O2.SiO32-等杂质 ④2CrO42-+2H+=Cr2O72-+H2O ② 蒸发 将所得溶液转移至蒸发皿中.加热蒸发溶液.使NaC1结晶析出 ③ 过滤 趁热过滤.将NaC1晶体与溶液分离 ④ 冷却.结晶 冷却滤液使K2Cr2O7结晶析出
网址:http://m.1010jiajiao.com/timu3_id_45194[举报]
A、B、C、D为同一周期的四种元素,原子序数依次增大,已知0.2摩A与酸充分反应时,在标况下可生成2.24升氢气;B的氧化物既可溶于强酸又可溶于强碱溶液;C、D阴离子的电子层结构与氩原子相同,C的气态氢化物与C的低价氧化物反应,又可得到C的单质.试回答:
(1)A、B、C、D的元素符号分别为
(2)用电子式表示A与C形成化合物的过程:
 .
.
(3)写出B的氧化物与A的氢氧化物反应的离子方程式:
(4)写出实验室制备D的单质的化学反应方程式:
查看习题详情和答案>>
(1)A、B、C、D的元素符号分别为
Na
Na
、Al
Al
、S
S
、Cl
Cl
.(2)用电子式表示A与C形成化合物的过程:


(3)写出B的氧化物与A的氢氧化物反应的离子方程式:
Al2O3+2OH-=AlO-+H2O
Al2O3+2OH-=AlO-+H2O
.(4)写出实验室制备D的单质的化学反应方程式:
MnO2+4HCl(浓)
MnCl2+Cl2↑+H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+H2O
.
| ||
(2012?南充模拟)硬质玻璃管是化学实验中经常使用的一种仪器,分析下列实验(固定装置略)并回答:
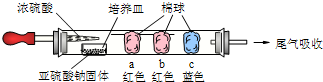
(1)进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表.
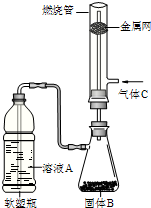 (2)如图所示,将硬质玻璃管改装为燃烧管.挤压软塑瓶壁,向装有固体B的锥形瓶中加入溶液A,同时往燃烧管中通入气体C并点燃,可看到明显的燃烧现象(金属网用以防止气体混合爆炸).
(2)如图所示,将硬质玻璃管改装为燃烧管.挤压软塑瓶壁,向装有固体B的锥形瓶中加入溶液A,同时往燃烧管中通入气体C并点燃,可看到明显的燃烧现象(金属网用以防止气体混合爆炸).
①用此装置模拟工业合成盐酸,则关于试剂选择正确的是
②若溶液A为饱和食盐水,气体C为氧气,燃烧管内观察到明亮火焰与浓烈的黑烟,则固体B为
查看习题详情和答案>>
(1)进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表.

| 棉球 | 棉球上滴加试剂 | 实验现象 | 解释或结论 |
| a | 品红溶液 品红溶液 |
棉球变白,微热后又恢复红色 | 解释: SO2与品红反应生成无色不稳定物质,遇热分解又生成SO2和品红 SO2与品红反应生成无色不稳定物质,遇热分解又生成SO2和品红 结论:该气体具有漂白性. |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: SO2+OH-=HSO3- SO2+OH-=HSO3- |
| c | 淀粉和 碘 碘 的混合溶液 |
棉球变为白色 | 化学方程式: SO2+I2+2H2O=H2SO4+2HI SO2+I2+2H2O=H2SO4+2HI 结论:该气体具有 还原 还原 性. |
 (2)如图所示,将硬质玻璃管改装为燃烧管.挤压软塑瓶壁,向装有固体B的锥形瓶中加入溶液A,同时往燃烧管中通入气体C并点燃,可看到明显的燃烧现象(金属网用以防止气体混合爆炸).
(2)如图所示,将硬质玻璃管改装为燃烧管.挤压软塑瓶壁,向装有固体B的锥形瓶中加入溶液A,同时往燃烧管中通入气体C并点燃,可看到明显的燃烧现象(金属网用以防止气体混合爆炸).①用此装置模拟工业合成盐酸,则关于试剂选择正确的是
d
d
(填序号),管口可观察到苍白
苍白
色火焰.| 溶液A | 固体B | 气体C | |
| a. | 稀硫酸 | Zn | Cl2 |
| b. | 浓盐酸 | MnO2 | H2 |
| c. | 稀硝酸 | Fe | Cl2 |
| d. | 浓盐酸 | KMnO4 | H2 |
CaC2
CaC2
(填化学式).此火焰温度极高,常用于切割焊接金属.有A、B、C、D四种元素,A元素形成的离子中只有一个质子,B原子的最外层电子数是次外层的3倍,C元素的一价阳离子核外有10个电子,D元素的原子得到一个电子后能形成与氩原子电子层结构相同的离子.回答下列列问题:
(1)画出D元素的离子结构示意图
 ;
;
(2)工业上用电解C和D两元素形成的化合物的水溶液生产D的单质,写出该反应的化学方程式
(3)D单质能和A、B、C三元素形成的化合物反应,该反应的化学方程式是
(4)B、C、D三元素能形成一种化合物,1mol该化合物中有36mol电子,该化合物的水溶液是一种
查看习题详情和答案>>
(1)画出D元素的离子结构示意图


(2)工业上用电解C和D两元素形成的化合物的水溶液生产D的单质,写出该反应的化学方程式
2NaCl+2H2O
Cl2↑+H2↑+2NaOH
| ||
2NaCl+2H2O
Cl2↑+H2↑+2NaOH
,电解后的溶液能使酚酞变红的是与电源的
| ||
负
负
极相连接的区域;(3)D单质能和A、B、C三元素形成的化合物反应,该反应的化学方程式是
Cl2+2NaOH=NaCl+NaClO+H2O
Cl2+2NaOH=NaCl+NaClO+H2O
,当有0.1mol的D单质反应时,电子转移0.1NA
0.1NA
个;(4)B、C、D三元素能形成一种化合物,1mol该化合物中有36mol电子,该化合物的水溶液是一种
消毒
消毒
剂,它与A、D两元素形成的化合物的水溶液反应时能产生一种有毒气体,该反应的化学方程式是NaClO+2HCl=NaCl+Cl2+H2O
NaClO+2HCl=NaCl+Cl2+H2O
.Ⅰ.氢气是一种清洁能源.
(1)已知 2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol;2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol
①表示氢气燃烧热的热化学方程式是
②燃烧2g H2生成水蒸气,放出的热量为
(2)人们可以通过多种途径获取氢气.14g CO与适量水蒸气反应生成CO2和H2,需放出20.5kJ热量,此反应的热化学方程式为
Ⅱ.煤是化石燃料.煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后是使得到的氢气和一氧化碳在充足的空气中燃烧.这两个过程的化学方程式为:
a.C(s)+O2(g)=CO2(g)△H=E1 ①
b.C(s)+H2O(g)=CO(g)+H2(g)△H=E2 ②
H2(g)+
O2(g)=H2O(g)△H=E3 ③
CO(g)+
O2(g)=CO2(g)△H=E4 ④
请回答:(1)上述四个热化学方程式中哪个反应△H>0?
(2)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是
A.a比b多 B. a比b少 C.a与b在理论上相同
Ⅲ.已知:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol
H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ/mol
N2(g)+2H2(g)+
Cl2(g)═NH4Cl(s)△H=-313.6kJ/mol
计算NH3(g)+HCl(g)═NH4Cl(s)的反应焓变:△H=
查看习题详情和答案>>
(1)已知 2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol;2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol
①表示氢气燃烧热的热化学方程式是
H2+
O2=H2O(l)△H=-285.8kJ/mol
| 1 |
| 2 |
H2+
O2=H2O(l)△H=-285.8kJ/mol
| 1 |
| 2 |
②燃烧2g H2生成水蒸气,放出的热量为
241.8
241.8
kJ.(2)人们可以通过多种途径获取氢气.14g CO与适量水蒸气反应生成CO2和H2,需放出20.5kJ热量,此反应的热化学方程式为
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol
.Ⅱ.煤是化石燃料.煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后是使得到的氢气和一氧化碳在充足的空气中燃烧.这两个过程的化学方程式为:
a.C(s)+O2(g)=CO2(g)△H=E1 ①
b.C(s)+H2O(g)=CO(g)+H2(g)△H=E2 ②
H2(g)+
| 1 |
| 2 |
CO(g)+
| 1 |
| 2 |
请回答:(1)上述四个热化学方程式中哪个反应△H>0?
②
②
(填序号)(2)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是
C
C
. A.a比b多 B. a比b少 C.a与b在理论上相同
Ⅲ.已知:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol
H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ/mol
| 1 |
| 2 |
| 1 |
| 2 |
计算NH3(g)+HCl(g)═NH4Cl(s)的反应焓变:△H=
-175.1kJ/mol
-175.1kJ/mol
.