网址:http://m.1010jiajiao.com/timu3_id_45177[举报]
(1)分液漏斗
(2)容量瓶
(3)带磨口玻璃塞的试剂瓶
(4)酸式滴定管
(5)锥形瓶
(6)烧杯
(7)碱式滴定管.
| A、(1)(3)(4) | B、(3)(4)(5) | C、(1)(2)(3)(4) | D、(3)(4)(5)(6) |
(11分)某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14mol·L-1 NaOH溶液滴定硫酸的实验操作如下:
A、用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入指示剂
B、用待测定的溶液润洗酸式滴定管
C、用蒸馏水洗干净滴定管
D、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2—3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E、检查滴定管是否漏水
F、另取锥形瓶,再重复操作一次
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①滴定操作的正确顺序是(用序号填写) ;
②该滴定操作中应选用的指示剂是 ;
③在G操作中如何确定终点? 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果 (填“偏低”、“偏高”或“无影响”)。
(3)如有1mol/L和0.1mol/L的NaOH溶液,应用_____ _的NaOH溶液,原因是______________ ________。
(4)用标准NaOH溶液滴定时,应将标准NaOH溶液注入下图中的 (选填“甲”或“乙”)中。

(5)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值 (填“偏低”、“偏高”或“无影响”)
(6)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度 (计算结果到小数点后二位)。
查看习题详情和答案>>
某化学兴趣小组在学习“硫酸盐的某些性质和用途”中,进行了如下实验探究:
【实验一】检验(NH4)2Fe(SO4)2·6H2O溶液中含有的阳离子。
(1)在下表中写出操作步骤和实验现象:
限选试剂:新制氯水、1mol/LH2SO4溶液、0.1mol/L KSCN溶液、NaOH浓溶液、浓盐酸、1mol/LNa2CO3溶液
|
操 作 步 骤 |
实验现象 |
结 论 |
|
步骤I:取少量待检液于试管中, 。 |
|
溶液中含有Fe2+ |
|
步骤II:取少量待检液于试管中, 。 |
|
溶液中含有NH4+ |
【实验二】用KHSO4制取H2O2并测其质量分数:
查阅资料得知:工业上用电解KHSO4饱和溶液可制取一定浓度的H2O2。兴趣小组进行下列实验测定H2O2的质量分数。已知:2MnO4-+5H2O2+6H+= 2Mn2++8H2O+5O2↑
操作①:取5.00 mL H2O2溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释,再加稀硫酸酸化;
操作②:用0.1000 mol/L KMnO4溶液滴定;
操作③:用同样方法滴定,四次消耗KMnO4溶液的体积分别为20.00 mL、19.98 mL、20.02 mL、22.00 mL。
回答下列问题:
(2)操作②中,开始滴入KMnO4溶液时反应速率很慢,随着KMnO4溶液滴入反应速率显著加快,最有可能的原因______________________。
(3)滴定时盛装KMnO4溶液应选取的仪器是 (填序号)。
A.50mL酸式滴定管 B.50mL碱式滴定管
C.25mL酸式滴定管 D.25mL碱式滴定管
(4)在上述实验中,下列操作会造成测定结果偏高的有 (填序号)。
A.锥形瓶用待测液润洗
B.量取 H2O2溶液的滴定管用蒸馏水洗净,未用H2O2溶液润洗
C.滴定速度过快,又未摇匀,停止滴定后发现紫红色褪去
D.滴定前读数时平视,滴定终点读数时仰视
(5)分析数据,计算H2O2溶液中溶质的质量百分含量为___________(保留三位有效数字)。
查看习题详情和答案>>
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00mL(酚酞作指示剂),滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14mol·L-1 NaOH溶液滴定硫酸的实验操作如下:
A、用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,滴入指示剂。
B、用待测定的溶液润洗酸式滴定管
C、用蒸馏水洗干净滴定管
D、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”
以上2—3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E、检查滴定管是否漏水
F、另取锥形瓶,再重复操作一次
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①滴定操作的正确顺序是(用序号填写);E→C→D→ → → →F;
②在G操作中如何确定终点? 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果
(填“偏小”、“偏大”或“不变”)。
(3)如有1mol/L和0.1mol/L的NaOH溶液,应用0.1mol/L的NaOH溶液,原因是______________ _____ ___。
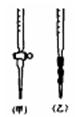
(4)用标准NaOH溶液滴定时,应将标准NaOH溶液注入 __(选填“甲”或“乙”)中。
(5)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度 (选填“偏大”“偏小”或“无影响”)
(6)计算待测硫酸(稀释前的硫酸)的物质的量浓度(保留到小数点后二位) 。
查看习题详情和答案>>