摘要:27.(1)I2 ,不是,碘易升华 (2)①C ②碘在水中的溶解度小而在四氯化碳中的溶解度大且四氯化碳与水互不相溶. (3)把华素片在水中研碎后.滴入淀粉溶液.若显蓝色.可验证华素片中含有碘分子 (4)用淀粉验证更合适 解析:(1)由信息知华素片中含碘单质.显然它不是白色的.由于碘易升华.故在遮光.密闭.凉处保存. (2)由于碘在水中的溶解度小而在四氯化碳中的溶解度大且四氯化碳与水互不相溶.故四氯化碳可把碘萃取.从而在下层观察到紫色.由于酒精.甘油与水混溶.故无法萃取碘单质.而热裂汽油中含有不饱和烃.与碘发生加成反应.故不能选酒精.甘油.热裂汽油做萃取剂. (3)由于碘与淀粉发生显色反应.故把华素片在水中研碎后.滴入淀粉溶液.若显蓝色.可验证华素片中含有碘分子. (4)在家庭小实验中要验证华素片的活性成分.其试剂显然是淀粉更方便.故此法更适合于家庭小实验.
网址:http://m.1010jiajiao.com/timu3_id_45007[举报]
(2011?浙江)食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的.已知:氧化性:IO3->Fe3+>I2;还原性:S2O32->I-3I2+6OH-═IO3-+5I-+3H2O;
KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份.第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色.
①加KSCN溶液显红色,该红色物质是
 (用电子式表示).
(用电子式表示).
②第二份试液中加入足量KI固体后,反应的离子方程式为
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失.写出潮湿环境下KI与氧气反应的化学方程式:
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失.下列物质中有可能作为稳定剂的是
A.Na2S2O3 B.AlCl3 C.Na2CO3 D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂.请设计实验方案,检验该加碘盐中的Fe2+.
查看习题详情和答案>>
KI+I2
 KI3
KI3(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份.第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色.
①加KSCN溶液显红色,该红色物质是
Fe(SCN)3
Fe(SCN)3
(用化学式表示);CCl4中显紫红色的物质是

②第二份试液中加入足量KI固体后,反应的离子方程式为
IO3-+5I-+6H+═3I2+3H2O
IO3-+5I-+6H+═3I2+3H2O
、2Fe3++2I-═2Fe2++I2
2Fe3++2I-═2Fe2++I2
.(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失.写出潮湿环境下KI与氧气反应的化学方程式:
4KI+O2+2H2O═2I2+4KOH
4KI+O2+2H2O═2I2+4KOH
.将I2溶于KI溶液,在低温条件下,可制得KI3?H2O.该物质作为食盐加碘剂是否合适?否
否
(填“是”或“否”),并说明理由KI3受热(或潮湿)条件下产生KI和I2,KI被氧气氧化,I2易升华
KI3受热(或潮湿)条件下产生KI和I2,KI被氧气氧化,I2易升华
.(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失.下列物质中有可能作为稳定剂的是
AC
AC
.A.Na2S2O3 B.AlCl3 C.Na2CO3 D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂.请设计实验方案,检验该加碘盐中的Fe2+.
取足量该加碘盐溶于蒸馏水中,用盐酸酸化,滴加适量氧化剂(如:氯水、过氧化氢等),再滴加KSCN溶液,若显血红色,则该加碘盐中存在Fe2+
取足量该加碘盐溶于蒸馏水中,用盐酸酸化,滴加适量氧化剂(如:氯水、过氧化氢等),再滴加KSCN溶液,若显血红色,则该加碘盐中存在Fe2+
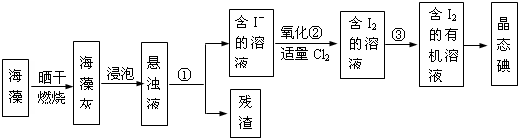
.海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在.实验室从海藻中提取碘的流程如图所示:(碘是一种易升华的固体,在水中溶解度度不大,易溶于苯、四氯化碳等有机溶剂,氯气能将溶液中的I-氧化成碘)
(1)指出从海藻中提取I2的实验操作名称:①
(2)提取碘的过程中,可供选择的有机溶剂是
A.酒精 B.四氯化碳 C.苯
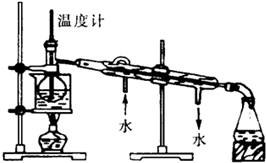
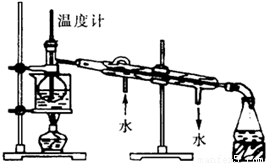
(3)从含碘的有机溶剂中提取碘,还要经过蒸馏,指出图所示的蒸馏装置中的错误之处
(4)进行蒸馏操作时,使用水浴加热的原因是
查看习题详情和答案>>

(1)指出从海藻中提取I2的实验操作名称:①
过滤
过滤
,③萃取
萃取
;(2)提取碘的过程中,可供选择的有机溶剂是
BC
BC
A.酒精 B.四氯化碳 C.苯
(3)从含碘的有机溶剂中提取碘,还要经过蒸馏,指出图所示的蒸馏装置中的错误之处
冷凝水水流的方向;温度计水银球的位置;未垫石棉网
冷凝水水流的方向;温度计水银球的位置;未垫石棉网

(4)进行蒸馏操作时,使用水浴加热的原因是
使受热均匀,防止温度过高
使受热均匀,防止温度过高
.