摘要:26.答案:(1)Cu2O+HNO3→Cu(NO3)2+NO↑+H2O (2)0.025 (3)0.005 0.005 (4)0.005<x<0.015 解析:(1)Cu2O跟稀硝酸反应的化学反应方程式为: Cu2O+HNO3→Cu(NO3)2+NO↑+H2O (2)发生氧化还原反应当硝酸的物质的量与NO的物质的量相等.即:
网址:http://m.1010jiajiao.com/timu3_id_45003[举报]
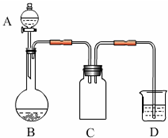 (2012?南京模拟)实验室一般用回收的粗铜屑(含少量Cu2O)与H2SO4、HNO3混合稀溶液反应制备CuSO4?5H2O晶体,反应可在如图所示装置中进行.
(2012?南京模拟)实验室一般用回收的粗铜屑(含少量Cu2O)与H2SO4、HNO3混合稀溶液反应制备CuSO4?5H2O晶体,反应可在如图所示装置中进行.回答下列问题:
(1)C装置的作用是
起到安全瓶的作用,防止D中溶液倒吸到反应装置B中
起到安全瓶的作用,防止D中溶液倒吸到反应装置B中
.(2)D装置中的NaClO-NaOH混合溶液用来吸收无色尾气,吸收液与尾气发生反应的离子方程式为
3ClO-+NO+2OH-═3Cl-+2NO3-+H2O
3ClO-+NO+2OH-═3Cl-+2NO3-+H2O
.(3)准确称取上述粗铜屑(设仅含Cu和Cu2O)3.28g,与足量稀硝酸充分反应,得到无色气体672.0mL(标准状况下).计算样品中Cu单质的质量分数(计算结果精确到小数点后两位).
(2013?普陀区二模)金属及其化合物变化多,用途广.请完成下列计算:
(1)等物质的量的镁在氧气中充分灼烧,产物质量为a g,比它在空气中灼烧所得产物增重b g.它在空气中灼烧后的产物中Mg3N2的质量分数是
(用a、b表示,只考虑空气中氮气、氧气参与反应).
(2)硬铝(因其主要成分,在此仅看作Al-Cu合金)常用于建筑装潢.1.18g某种硬铝恰好与10mL某浓度的硝酸完全反应,生成的混合气体(其中NO2与NO的体积比为2:1)再与448mL氧气(标准状况)混合,恰好能被水完全吸收.
①计算该硝酸的物质的量浓度.
②计算并确定此种硬铝的化学式.
③取5.1g Al-Mg合金与200mL 1mol?L-1的NaOH(aq)充分反应,产生气体a L.过滤,向滤液中通入V L CO2后开始出现沉淀,继续通入CO2使沉淀完全.过滤、洗涤、干燥、灼烧,得到固体5.1g.则a=
④向Cu、Cu2O和CuO的混合粉末中加入500mL 0.6mol?L-1 HNO3(aq),恰好完全溶解,同时收集到1120mL NO(标准状况).通过计算推断混合粉末中Cu的物质的量.
查看习题详情和答案>>
(1)等物质的量的镁在氧气中充分灼烧,产物质量为a g,比它在空气中灼烧所得产物增重b g.它在空气中灼烧后的产物中Mg3N2的质量分数是
| 5b |
| a-b |
| 5b |
| a-b |
(2)硬铝(因其主要成分,在此仅看作Al-Cu合金)常用于建筑装潢.1.18g某种硬铝恰好与10mL某浓度的硝酸完全反应,生成的混合气体(其中NO2与NO的体积比为2:1)再与448mL氧气(标准状况)混合,恰好能被水完全吸收.
①计算该硝酸的物质的量浓度.
②计算并确定此种硬铝的化学式.
③取5.1g Al-Mg合金与200mL 1mol?L-1的NaOH(aq)充分反应,产生气体a L.过滤,向滤液中通入V L CO2后开始出现沉淀,继续通入CO2使沉淀完全.过滤、洗涤、干燥、灼烧,得到固体5.1g.则a=
3.36L
3.36L
,V=1.12 L
1.12 L
.(气体体积均为标准状况)④向Cu、Cu2O和CuO的混合粉末中加入500mL 0.6mol?L-1 HNO3(aq),恰好完全溶解,同时收集到1120mL NO(标准状况).通过计算推断混合粉末中Cu的物质的量.
将下列四种物质:NO、Cu(NO3)2、Cu2O、HNO3的化学式分别填在空白处,并组成一个配平了的化学方程式:
(1)该反应中的还原剂是
(2)该反应中被氧化的物质和被还原的物质物质的量之比为
(3)写出该反应的离子方程式,并标出电子转移的方向和数目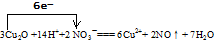
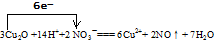 .
.
查看习题详情和答案>>
3Cu2O
3Cu2O
+14HNO3
14HNO3
-6Cu(NO3)2
6Cu(NO3)2
+2NO↑
2NO↑
+7
7
H2O(1)该反应中的还原剂是
Cu2O
Cu2O
.该反应中还原产物是NO
NO
.(2)该反应中被氧化的物质和被还原的物质物质的量之比为
3:2
3:2
(3)写出该反应的离子方程式,并标出电子转移的方向和数目
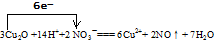
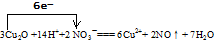
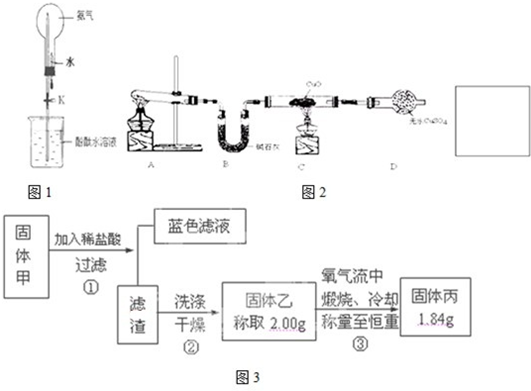
Ⅰ.氨是一种重要的化工原料,某学习小组欲制取氨气并探究其性质.
请回答:
(1)实验室制取氨气的化学方程式是
(2)①如图1是进行氨气喷泉实验的装置,引发喷泉的操作步骤是
②氨气使烧杯中溶液由无色变为红色,其原因是(用电离方程式 表示)
(3)该小组同学设计了图2所示的实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物.
①实验现象为:黑色CuO变为红色;白色无水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染.请写出氨气与CuO反应的化学方程式
②碱石灰的作用是
③整套装置在方框处应添加一种装置后,此实验设计才较完善,请在方框中补画出E装置图(要求 注明装置中所加试剂名称)
 .
.
Ⅱ.3.2g Cu与30mL,8mol/L过量HNO3反应,硝酸的还原产物为NO,NO2,反应后溶液中所含H+为a mol,则:①此时溶液中所含的NO3-为
②所生成的NO在标准状况下体积为
Ⅲ.某黑色固体甲可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜.
查阅资料知道:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜.
②硫化铜和硫化亚铜常温下都不溶于稀盐酸.在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫.为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图3所示的实验:
(1)③中在煅烧过程中一定发生的反应的化学方程式为
(2)关于固体甲的成分的判断中,下列说法正确的是
A.固体甲中,CuS和Cu2S不能同时存在;
B.固体甲中,CuO和Cu2O至少有一种;
C.固体甲中若没有Cu2O,则一定有Cu2S;
D.固体甲中若存在Cu2O,也可能有Cu2S.
查看习题详情和答案>>

请回答:
(1)实验室制取氨气的化学方程式是
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
.
| ||
(2)①如图1是进行氨气喷泉实验的装置,引发喷泉的操作步骤是
轻轻挤压滴管,使少量水加入烧瓶,然后打开止水夹K
轻轻挤压滴管,使少量水加入烧瓶,然后打开止水夹K
.②氨气使烧杯中溶液由无色变为红色,其原因是(用电离方程式 表示)
NH3+H2O?NH3?H2O?NH4++OH-
NH3+H2O?NH3?H2O?NH4++OH-
.(3)该小组同学设计了图2所示的实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物.
①实验现象为:黑色CuO变为红色;白色无水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染.请写出氨气与CuO反应的化学方程式
3CuO+2NH3
3Cu+N2+3H2O
| ||
3CuO+2NH3
3Cu+N2+3H2O
.
| ||
②碱石灰的作用是
吸收氨气中混有的水蒸气,防止干扰产物水的测定
吸收氨气中混有的水蒸气,防止干扰产物水的测定
.③整套装置在方框处应添加一种装置后,此实验设计才较完善,请在方框中补画出E装置图(要求 注明装置中所加试剂名称)


Ⅱ.3.2g Cu与30mL,8mol/L过量HNO3反应,硝酸的还原产物为NO,NO2,反应后溶液中所含H+为a mol,则:①此时溶液中所含的NO3-为
0.1+a
0.1+a
mol.②所生成的NO在标准状况下体积为
(0.02-0.5a)×22.4
(0.02-0.5a)×22.4
L.(以上结果均用含a的代数式表示)Ⅲ.某黑色固体甲可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜.
查阅资料知道:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜.
②硫化铜和硫化亚铜常温下都不溶于稀盐酸.在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫.为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图3所示的实验:
(1)③中在煅烧过程中一定发生的反应的化学方程式为
2CuS+3O2
2CuO+2SO2
| ||
2CuS+3O2
2CuO+2SO2
.
| ||
(2)关于固体甲的成分的判断中,下列说法正确的是
BCD
BCD
A.固体甲中,CuS和Cu2S不能同时存在;
B.固体甲中,CuO和Cu2O至少有一种;
C.固体甲中若没有Cu2O,则一定有Cu2S;
D.固体甲中若存在Cu2O,也可能有Cu2S.
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
(1)气体A中的大气污染物可选用下列试剂中的
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在
(3)由泡铜(主要成分为Cu2O、Cu)冶炼粗铜的化学反应方程式为
查看习题详情和答案>>

(1)气体A中的大气污染物可选用下列试剂中的
c、d
c、d
吸收.a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在
Fe3+
Fe3+
(填离子符号),检验溶液中还存在Fe2+的方法是取少量溶液,滴加KMnO4溶液,KMnO4褪色,则溶液中存在Fe2+
取少量溶液,滴加KMnO4溶液,KMnO4褪色,则溶液中存在Fe2+
(注明试剂、现象).(3)由泡铜(主要成分为Cu2O、Cu)冶炼粗铜的化学反应方程式为
3Cu2O+2Al
Al2O3+6Cu
| ||
3Cu2O+2Al
Al2O3+6Cu
.
| ||