摘要:22.答案:(1)①碳酸氢钠放出气泡快 ②碳酸氢钠.53:42 ③不正确 (2)①关于碳酸氢钠与碳酸钠与盐酸反应热效应的研究 ②温度计.托盘天平 吸热 放热 吸热.放热 a.c 解析:(1)NaHCO3和Na2CO3与稀盐酸的反应.前者反应速率块.故反应开始时.盛碳酸氢钠的试管中放出气泡快.产生的CO2气体多.气球体积先变大.由关系式NaHCO3-HCl-CO2.Na2CO3-2HCl-CO2可知.NaHCO3.Na2CO3分别与3mL4mol·L-1盐酸完全反应时.需二者的质量分别为:1.008g.0.636g.故均为0.3 g 的NaHCO3.Na2CO3不足.二者全反应掉.产生CO2的体积比约为=53:42. 同学仅通过感官的冷.热得出“不管其状态如何.NaHCO3和HCl反应为吸热反应.而Na2CO3和HCl反应为放热反应 的结论是不正确的.因为NaHCO3.Na2CO3固体与稀盐酸反应的反应热是通过NaHCO3.Na2CO3固体溶解的热效应和其饱和溶液与盐酸反的应热效应之和来计算的. (2)该实验是研究物质反应的热量变化的.所以该研究报告的题目是.该实验中所用的仪器有试管.药匙.气球.玻璃棒.烧杯.量筒.保温瓶.温度计.托盘天平等.通过分析上述表中的数据.知:NaHCO3的溶解是吸热过程,Na2CO3的溶解是放热过程,NaHCO3的饱和溶液和盐酸的反应是吸热反应,Na2CO3的饱和溶液和盐酸的反应是放热反应.NaHCO3固体与稀盐酸反应的反应热是NaHCO3的溶解和NaHCO3的饱与溶液和盐酸的反应二者的热效应之和.
网址:http://m.1010jiajiao.com/timu3_id_44996[举报]
下列叙述中不正确的是
[ ]
A.热稳定性:碳酸钠比碳酸氢钠稳定
B.溶解性:碳酸钠比碳酸氢钠易溶于水
C.质量相同的碳酸钠和碳酸氢钠分别与足量盐酸充分反应后,碳酸氢钠放出二氧化碳多
D.碳酸钠和碳酸氢钠分别与足量相同质量分数的盐酸反应,反应速率碳酸钠比碳酸氢钠大
查看习题详情和答案>>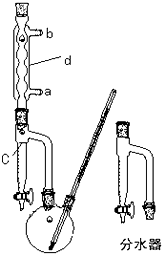 (2013?绍兴二模)苯甲酸乙酯(C9H10O2)(Mr=150)(密度1.05g?cm-3)稍有水果气味,用于配制香水香精和人造精油;也大量用于食品中,也可用作有机合成中间体、溶剂如纤维素酯、纤维素醚、树脂等.可能用到的数据:
(2013?绍兴二模)苯甲酸乙酯(C9H10O2)(Mr=150)(密度1.05g?cm-3)稍有水果气味,用于配制香水香精和人造精油;也大量用于食品中,也可用作有机合成中间体、溶剂如纤维素酯、纤维素醚、树脂等.可能用到的数据:| 沸点(℃,1atm) | ||||||
| 苯甲酸 | 苯甲酸乙酯 | 石油醚 | 水 | 乙醇 | 环己烷 | 共沸物(环已烷-水-乙醇) |
| 249 | 212.6 | 40-80 | 100 | 78.3 | 80.75 | 62.6 |
制备过程:
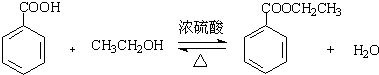
(1)制备粗产品:如图所示的装置中,于50mL圆底烧瓶中加入8.0g苯甲酸(固体)(Mr=122)、20mL乙醇(Mr=46)、15mL环己烷、3mL浓硫酸,摇匀,加沸石.在分水器上加水至c处,接通冷凝水,水浴回流约2h,反应基本完成.记录体积,继续蒸出多余的环己烷和乙醇(从分水器中放出).
(2)粗产品的纯化:加水30mL,分批加入固体NaHCO3.分液,水层用20mL石油醚分两次萃取.合并有机层,用无水硫酸镁干燥.回收石油醚,加热精馏,收集210-213℃馏分.
(1)仪器d的名称
冷凝管、水冷凝管或球形冷凝管
冷凝管、水冷凝管或球形冷凝管
,水流方向为a
a
进b
b
出.(2)该反应水浴控制的温度为
略高于62.6℃
略高于62.6℃
.(3)该反应加过量乙醇的目的为
乙醇相对廉价,增大反应物浓度,使平衡向正反应方向移动,提高苯甲酸的转化率,提高产率;形成恒沸物需要添加乙醇
乙醇相对廉价,增大反应物浓度,使平衡向正反应方向移动,提高苯甲酸的转化率,提高产率;形成恒沸物需要添加乙醇
.(4)分水器的作用
分离产生的水,使平衡向正反应方向移动,提高转化率
分离产生的水,使平衡向正反应方向移动,提高转化率
,分水器的检漏方法关闭活塞,在分水器中加适量的水,观察是否漏水,若不漏水,旋转活塞180°,若仍不漏水,说明分水器不漏水
关闭活塞,在分水器中加适量的水,观察是否漏水,若不漏水,旋转活塞180°,若仍不漏水,说明分水器不漏水
.如何利用实验现象判断反应已基本完成加热回流至分水器中水位不再上升
加热回流至分水器中水位不再上升
.(5)固体碳酸氢钠的作用
中和硫酸和未反应的苯甲酸
中和硫酸和未反应的苯甲酸
,加至不再有气泡产生或pH=7
不再有气泡产生或pH=7
为止.(6)经精馏得210-213℃馏分7.0mL,则该反应的产率为
73.7%
73.7%
.可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法是( )
| A、加热时有气体放出 | B、滴加盐酸时有气泡放出 | C、溶于水后滴加BaCl2稀溶液有白色沉淀生成 | D、溶于水后滴加澄清石灰水有白色沉淀生成 |