网址:http://m.1010jiajiao.com/timu3_id_44738[举报]
案经老师批准后进行试验,实验现象记录如下表(实验方案4、5盐酸浓度因记
录表中数据模糊,分别用a、b表示):
| 实验方案 | 实验现象 |
| 1,用砂纸打磨后的镁条与沸水反应,再向反应液中滴加酚酞 2,向新制的H2S饱和溶液中滴加新制的氯水 3,钠与滴有酚酞试液的冷水反应 4,镁条与amol/L的盐酸反应 5,铝条与bmol/L的盐酸反应 6,向AlCl3溶液中滴加NaOH溶液至过量 |
I.浮于水面,熔成小球,四处游动,逐渐缩小,溶液变红色 I I.放出无色气体,气体可燃,溶液变浅红色 III.反应不十分强烈,产生的气体可燃 IV.剧烈反应,产生的气体可燃 V.生成白色絮状沉淀,继而沉淀消失 VI.生成淡黄色沉淀 |
(1)该同学的实验目的为
(2)请比较a、b的大小关系(选择“>”、“<”、“=”填空):a
(3)完成实验方案3除需要烧杯、小刀、玻璃片、胶头滴管等外,还必须用到的一种仪器名称是
(4)请根据记录表填写实验现象序号对应的实验方案编号:
I
(5)请分别写出下列实验方案中各现象对应的离子方程式:
实验方案2:
实验方案3:
(6)该实验结论是
某兴趣小组设计并进行了以下实验来制取氯水,并利新制用氯水完成实验。
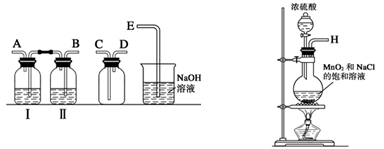
(1)实验室拟用下列装置制备氯水,请按照气体从左向右流动的方向将仪器进行连接:
H→ _____________(填接口处的符号);广口瓶Ⅱ中的试剂为 。

(2)写出该实验中制取Cl2的化学方程式为:___________________________________
(3)某兴趣小组设计实验除去氯化钾中含有Fe3+、SO42-、Br-等杂质离子,步骤如下:
A.溶解,在所得溶液中加入试剂至Fe3+、SO42-沉淀完全,煮沸;
B.过滤,在滤液中加入盐酸调节pH;
C.加入_____(除Br-);蒸干灼烧。请回答问题:
(3)①步骤a中,依次加入的试剂是NH3.H2O、_________、_________。
②步骤c中加入的试剂是__________________。
(4)某研究性学习小组用KSCN检验FeSO4溶液中的Fe2+时,加入过量浓HNO3,溶液的颜色变红。但是将红色溶液放置一会则发现溶液由红色突然变为蓝色,并产生红棕色气体。对这一奇特现象同学们进行了以下探究。
[查阅资料]:
(SCN)2称为拟卤素,性质与卤素单质相似,(SCN)2、Cl2、Br2、I2四种物质的氧化性强弱为:Cl2>Br2>(SCN)2>I2。
[提出假设]:
①甲同学假设是FeSO4与HNO3作用;乙同学假设是______与HNO3作用。
[实验验证]:
②大家经过理性分析,认为甲同学的假设不成立。理由是________________________。
③根据乙同学的假设,设计了如下实验方案进行验证:向浓HNO3中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深色,突然剧烈反应产生大量气泡,放出红棕色气体。将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种气体(是空气中的主要成分之一);向反应后的溶液中加入BaCl2溶液产生白色沉淀。
则反应中产生的气体是:_______________________________
[实验结论]:乙同学假设正确。
[实验反思]:
④由实验可知:用SCN-间接检验Fe2+时,加入的氧化剂除用HNO3外还可以选择氯水等,通过该实验探究可知加入氧化剂的量必须要_______(填“少量”、“过量”)。
查看习题详情和答案>>
某兴趣小组设计并进行了以下实验来制取氯水,并利新制用氯水完成实验。
(1)实验室拟用下列装置制备氯水,请按照气体从左向右流动的方向将仪器进行连接:
H→ _____________(填接口处的符号);广口瓶Ⅱ中的试剂为 。
(2)写出该实验中制取Cl2的化学方程式为:___________________________________
(3)某兴趣小组设计实验除去氯化钾中含有Fe3+、SO42-、Br-等杂质离子,步骤如下:
A.溶解,在所得溶液中加入试剂至Fe3+、SO42-沉淀完全,煮沸;
B.过滤,在滤液中加入盐酸调节pH;
C.加入_____(除Br-);蒸干灼烧。请回答问题:
(3)①步骤a中,依次加入的试剂是NH3.H2O、_________、_________。
②步骤c中加入的试剂是__________________。
(4)某研究性学习小组用KSCN检验FeSO4溶液中的Fe2+时,加入过量浓HNO3,溶液的颜色变红。但是将红色溶液放置一会则发现溶液由红色突然变为蓝色,并产生红棕色气体。对这一奇特现象同学们进行了以下探究。
[查阅资料]:
(SCN)2称为拟卤素,性质与卤素单质相似,(SCN)2、Cl2、Br2、I2四种物质的氧化性强弱为:Cl2>Br2>(SCN)2>I2。
[提出假设]:
①甲同学假设是FeSO4与HNO3作用;乙同学假设是______与HNO3作用。
[实验验证]:
②大家经过理性分析,认为甲同学的假设不成立。理由是________________________。
③根据乙同学的假设,设计了如下实验方案进行验证:向浓HNO3中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深色,突然剧烈反应产生大量气泡,放出红棕色气体。将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种气体(是空气中的主要成分之一);向反应后的溶液中加入BaCl2溶液产生白色沉淀。
则反应中产生的气体是:_______________________________
[实验结论]:乙同学假设正确。
[实验反思]:
④由实验可知:用SCN-间接检验Fe2+时,加入的氧化剂除用HNO3外还可以选择氯水等,通过该实验探究可知加入氧化剂的量必须要_______(填“少量”、“过量”)。
(1)实验室拟用下列装置制备氯水,请按照气体从左向右流动的方向将仪器进行连接:
H→ _____________(填接口处的符号);广口瓶Ⅱ中的试剂为 。
(2)写出该实验中制取Cl2的化学方程式为:___________________________________
(3)某兴趣小组设计实验除去氯化钾中含有Fe3+、SO42-、Br-等杂质离子,步骤如下:
A.溶解,在所得溶液中加入试剂至Fe3+、SO42-沉淀完全,煮沸;
B.过滤,在滤液中加入盐酸调节pH;
C.加入_____(除Br-);蒸干灼烧。请回答问题:
(3)①步骤a中,依次加入的试剂是NH3.H2O、_________、_________。
②步骤c中加入的试剂是__________________。
(4)某研究性学习小组用KSCN检验FeSO4溶液中的Fe2+时,加入过量浓HNO3,溶液的颜色变红。但是将红色溶液放置一会则发现溶液由红色突然变为蓝色,并产生红棕色气体。对这一奇特现象同学们进行了以下探究。
[查阅资料]:
(SCN)2称为拟卤素,性质与卤素单质相似,(SCN)2、Cl2、Br2、I2四种物质的氧化性强弱为:Cl2>Br2>(SCN)2>I2。
[提出假设]:
①甲同学假设是FeSO4与HNO3作用;乙同学假设是______与HNO3作用。
[实验验证]:
②大家经过理性分析,认为甲同学的假设不成立。理由是________________________。
③根据乙同学的假设,设计了如下实验方案进行验证:向浓HNO3中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深色,突然剧烈反应产生大量气泡,放出红棕色气体。将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种气体(是空气中的主要成分之一);向反应后的溶液中加入BaCl2溶液产生白色沉淀。
则反应中产生的气体是:_______________________________
[实验结论]:乙同学假设正确。
[实验反思]:
④由实验可知:用SCN-间接检验Fe2+时,加入的氧化剂除用HNO3外还可以选择氯水等,通过该实验探究可知加入氧化剂的量必须要_______(填“少量”、“过量”)。
(一)提出猜想:
(二)查阅资料:①Cu2O属于碱性氧化物; ②Cu+在酸性条件下能发生自身氧化还原反应;③在空气中灼烧Cu2O能生成CuO.
(三)制备红色沉淀:①制备氢氧化铜悬浊液②氢氧化铜悬浊液与葡萄糖共热.③过滤、洗涤、低温烘干得红色粉末.
(四)红色沉淀探究
该同学设计了四种方案:
方案Ⅰ:取该红色粉末溶于足量稀硝酸中,观察溶液颜色变化.
方案Ⅱ:取该红色粉末溶于足量稀硫酸中,观察是否有残渣.
方案Ⅲ:称得干燥坩埚a g,取红色粉末置于坩埚中再称得质量为b g,在空气中充分灼烧至完全变黑,并在干燥器中冷却,再称量,反复多次直到质量不变,称得最后质量为c g,比较a、b、c的关系.
方案Ⅳ:装置如图所示:(夹持仪器略去)
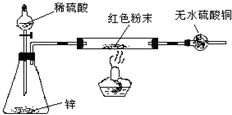
试回答下列问题:
(1)请你评价方案Ⅰ和方案Ⅱ.如果你认为该方案合理,请简述其工作原理;
如果你认为该方案不合理,请简述原因.
(2)方案Ⅲ中,如果a、b、c的关系符合c=
(3)方案Ⅳ中,实验前应检验装置气密性,请简述如何检验.
(4)方案Ⅳ中,要测定红色粉末的成分,必须测定下列哪些物理量
①通入氢气体积 ②反应前,红色粉末+双通管的总质量 ③实验前干燥管的质量④完全反应后,红色粉末+双通管的总质量 ⑤双通管的质量 ⑥锌粒质量 ⑦稀硫酸的物质的量浓度 ⑧实验后干燥管的质量 ⑨实验条件下的大气压强和室温
(5)有人提出,在氢气发生器与双通管之间应加一个干燥装置,你认为