网址:http://m.1010jiajiao.com/timu3_id_44076[举报]
| 催化剂 | △ |
请回答下列问题:
(1)判断该反应达到平衡状态的标志是
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
(3)求该反应达到平衡时SO2的转化率(用百分数表示).
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?
(1)甲同学认为是溶液中的Fe2+的干扰造成的,大家经过理性分析,认为可以排除Fe2+的干扰,理由是
(2)乙同学认为红色消失,说明Fe(SCN)3被破坏,红棕色NO2说明了某些离子与HNO3发生了氧化还原反应,推测可能是KSCN与HNO3作用.根据C、S、N的原子结构和共价键的相关知识推断SCN-的结构式为
(3)根据乙同学的,观点,设计了实验方案1,往浓HNO3中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深红色,突然剧烈反应产生大量气泡,放出红棕色气体,而溶液红色消失变为浅绿色,溶液温度升高;继续滴入KSCN溶液变为浅蓝色,最后变为无色.将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种非极性气体;向反应后的溶液中加入BaCl2溶液产生白色沉淀.(此过程中溶液颜色变化不必细究),请写出向浓HNO3中滴入KSCN离子的方程式:
(4)丙同学认为SCN-的性质 还可进一步探究,设计了方案2,向Fe(SCN)3中分别滴加过量的氯水.溴水,溶液的红色均消失变为黄色,而加入过量的碘水时溶液的颜色基本不变.丙同学的设计意图是
(5)通过本次探究,可知用SCN-间接检验Fe2+时应注意
| ||
| △ |
(1)求该反应达到平衡时SO2的转化率(用百分数表示).
(2)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?(要有解题过程)
将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃
时,在催化剂作用下发生反应:2SO2+O2 ![]() 2SO3(正反应放热)。反应达到平衡后,将容
2SO3(正反应放热)。反应达到平衡后,将容
器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子
酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计
算结果保留一位小数)
![]() 请回答下列问题:
请回答下列问题:![]()
![]()
![]()
![]()
![]() (1)判断该反应达到平衡状态的标志是 。(填字母)
(1)判断该反应达到平衡状态的标志是 。(填字母)
![]() a.SO2和SO3浓度相等 b.SO2百分含量保持不变
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
![]() c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
![]() e.容器中混合气体的密度保持不变
e.容器中混合气体的密度保持不变
![]() (2)欲提高SO2的转化率,下列措施可行的是 。(填字母)
(2)欲提高SO2的转化率,下列措施可行的是 。(填字母)
![]() a.向装置中再充入N2 b.向装置中再充入O2
a.向装置中再充入N2 b.向装置中再充入O2
![]() c.改变反应的催化剂 d.生高温度
c.改变反应的催化剂 d.生高温度
![]() (3)求该反应达到平衡时SO3的转化率(用百分数表示)。
(3)求该反应达到平衡时SO3的转化率(用百分数表示)。
![]() (4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?
将一定量的SO和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2
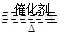 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
请回答下列问题:
(1)(2分)判断该反应达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d. SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)(2分)欲提高SO2的转化率,下列措施可行的是 。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
(3)(3分)求该反应达到平衡时SO3的转化率(用百分数表示)。
(4)(3分)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?
查看习题详情和答案>>