网址:http://m.1010jiajiao.com/timu3_id_43627[举报]
(14分)能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景,因此甲醇被称为21世纪的新型燃料。工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。

请回答下列问题:
(1)在“图1”中,曲线 (填“a”或“b”)表示使用了催化剂;该反应属于 (填“吸热”或“放热”)反应。
(2)根据“图2”判断,下列说法不正确的是
A.起始充入的CO为1mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会增大
(3)从反应开始到建立平衡, v(H2)=
;该温度下CO(g)+2H2(g)
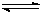 CH3OH(g)的化学平衡常数为 。若保持其它条件不变,将反应体系升温,则该反应的化学平衡常数将 (填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为 。若保持其它条件不变,将反应体系升温,则该反应的化学平衡常数将 (填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇蒸气百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1>P2)。
(5)科学家常用 (填仪器名称)来直接测定某一反应的反应热,现测得:CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol,又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。
查看习题详情和答案>>
(14分)能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景,因此甲醇被称为21世纪的新型燃料。工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。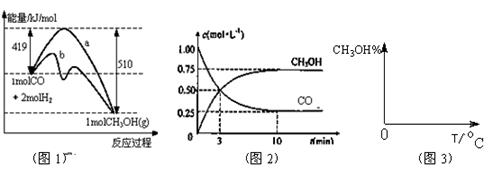
请回答下列问题:
(1)在“图1”中,曲线 (填“a”或“b”)表示使用了催化剂;该反应属于 (填“吸热”或“放热”)反应。
(2)根据“图2”判断,下列说法不正确的是
| A.起始充入的CO为1mol |
| B.增加CO浓度,CO的转化率增大 |
| C.容器中压强恒定时,反应已达平衡状态 |
| D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会增大 |
 CH3OH(g)的化学平衡常数为 。若保持其它条件不变,将反应体系升温,则该反应的化学平衡常数将 (填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为 。若保持其它条件不变,将反应体系升温,则该反应的化学平衡常数将 (填“增大”、“减小”或“不变”)。(4)请在“图3”中画出平衡时甲醇蒸气百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1>P2)。
(5)科学家常用 (填仪器名称)来直接测定某一反应的反应热,现测得:CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol,又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。 查看习题详情和答案>>
能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景,因此甲醇被称为21世纪的新型燃料。工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。

请回答下列问题:
(1)在“图1”中,曲线 (填“a”或“b”)表示使用了催化剂;该反应属于 (填“吸热”或“放热”)反应。
(2)根据“图2”判断,下列说法不正确的是
A.起始充入的CO为1mol ks5u
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态ks5u
D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会增大ks5u
(3)从反应开始到建立平衡, v(H2)= ;该温度下CO(g)+2H2(g) ![]() CH3OH(g)的化学平衡常数为 。若保持其它条件不变,将反应体系升温,则该反应的化学平衡常数将 (填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为 。若保持其它条件不变,将反应体系升温,则该反应的化学平衡常数将 (填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇蒸气百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1>P2)。
(5)科学家常用 (填仪器名称)来直接测定某一反应的反应热,现测得:CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol,又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。
查看习题详情和答案>>
 有相同的电子及空间构型.依此原理将下表中空格填出相应的化学式.
有相同的电子及空间构型.依此原理将下表中空格填出相应的化学式.
