摘要:28.请解释:氮可以形成NCl3.没有NCl5,而磷有既有PCl3 .也有PCl5.其原因是什么?
网址:http://m.1010jiajiao.com/timu3_id_435236[举报]
氮可以形成多种离子,如N3-、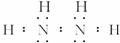 、
、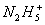 、
、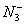 、
、 、
、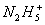 、
、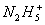 等。已知
等。已知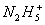 的形成过程类似于
的形成过程类似于 的形成过程,
的形成过程,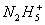 在碱性溶液中会生成电中性的分子和水。试填写下列空白:
在碱性溶液中会生成电中性的分子和水。试填写下列空白:
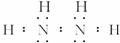 、
、(1)该电中性分子的化学式______________,电子式______________。
(2)一个![]() 具有______________个电子。
具有______________个电子。
(3)写出两种由多原子组成的含有与![]() 电子数相同的微粒的化学式______________。
电子数相同的微粒的化学式______________。
(4)试解释![]() 的形成过程。
的形成过程。
氮可以形成多种离子,如N3-、NH2 -、NH2、N3、NH4+、N2H5+、N2H62+等,已知N2H5+与N2H62+是由中 性分子结合质子形成的,类似于NH4+,因此有类似于NH4+的性质。
(1)写出N2H62+与足量的NaOH溶液反应的离子方程式:___。
(2)N2O、CO2、CNO -都与N3-互为等电子体,它们具有相似的结构,则请写出N3-的电子式为___。
(3)据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种阳离子“N5n+”,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N三N键。请写出 “N5n+”带具体电荷的电子式和结构式:___、____。
(4)请你预计科学家即将合成的N8属于___(填“单质”、“共价化合物”或“离子化合物”);其电子式为___,请写出其含有的所有化学键的类型:___;预计它在常温下是___体,熔沸点__(填“低”、“较高”或“高”),熔融状态下___(填“会”或“不会”)导电。
查看习题详情和答案>>
(1)写出N2H62+与足量的NaOH溶液反应的离子方程式:___。
(2)N2O、CO2、CNO -都与N3-互为等电子体,它们具有相似的结构,则请写出N3-的电子式为___。
(3)据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种阳离子“N5n+”,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N三N键。请写出 “N5n+”带具体电荷的电子式和结构式:___、____。
(4)请你预计科学家即将合成的N8属于___(填“单质”、“共价化合物”或“离子化合物”);其电子式为___,请写出其含有的所有化学键的类型:___;预计它在常温下是___体,熔沸点__(填“低”、“较高”或“高”),熔融状态下___(填“会”或“不会”)导电。
氮可以形成多种离子,如:N3-、![]() 、
、![]() 、
、![]() 、
、![]() 等,请回答下列问题.
等,请回答下列问题.
(1)氮化钠可与水反应产生NH3,Na3N的电子式是________,Na3N与盐酸反应可生成________种盐,其电子式分别是________,在Na3N中两种微粒的半径r(Na+)________r(N3-)(填“大于”“小于”或“等于”).
(2)已知![]() 中5个N原子结合后都达到8电子结构,且含有两个N≡N键,则
中5个N原子结合后都达到8电子结构,且含有两个N≡N键,则![]() 的电子式是________.
的电子式是________.
(3)一个![]() 共有________个电子,写出两个由多种原子组成的跟
共有________个电子,写出两个由多种原子组成的跟![]() 电子数相同的物质的分子式________.
电子数相同的物质的分子式________.
(4)若已知![]() 的形成过程类似于
的形成过程类似于![]() 的形成,
的形成,![]() 的电子式是________.
的电子式是________.
 氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.
氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.(1)已知:N2(g)+2H2(g)═N2H4(l);△H=+50.6kJ?mol-1
2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ?mol-1
①N2H4(l)+O2(g)═N2(g)+2H2O(l);△H=
-622.2
-622.2
kJ?mol-1.②N2(g)+2H2(g)═N2H4(l)不能自发进行的原因是
△H>0,△S<0
△H>0,△S<0
.③用次氯酸钠氧化氨气,可以得到N2H4的稀溶液,该反应的化学方程式是
NaClO+2NH3═N2H4+NaCl+H2O
NaClO+2NH3═N2H4+NaCl+H2O
.(2)采矿废液中的CN-可用H2O2处理.已知:H2SO4═H++HSO
- 4 |
- 4 |
2- 4 |
2- 8 |
2- 8 |
2HSO4--2e-═S2O82-+2H+
2HSO4--2e-═S2O82-+2H+
.(3)氧化镁处理含NH
+ 4 |
MgO+H2O?Mg(OH)2;
Mg(OH)2+2NH
+ 4 |
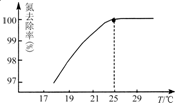
①温度对氮处理率的影响如图所示.在25℃前,升高温度氮去除率增大的原因是
升高温度NH3的溶解度降低,有利于NH3的逸出
升高温度NH3的溶解度降低,有利于NH3的逸出
.②剩余的氧化镁,不会对废水形成二次污染,理由是
氧化镁难溶于水中,以沉淀的形式排出,因此不会形成二次污染
氧化镁难溶于水中,以沉淀的形式排出,因此不会形成二次污染
.(4)滴定法测废水中的氨氮含量(氨氮以游离氨或铵盐形式存在于水中)步骤如下:①取10mL废水水样于蒸馏烧瓶中,再加蒸馏水至总体积为175mL;②先将水样调至中性,再加入氧化镁使水样呈微碱性,加热;③用25mL硼酸吸收蒸馏出的氨[2NH3+4H3BO3═(NH4)2B4O7+5H2O];④将吸收液移至锥形瓶中,加入2滴指示剂,用c mol?L-1的硫酸滴定至终点[(NH4)2B4O7+H2SO4+5H2O═(NH4)2SO4+4H3BO3],记录消耗的体积V mL.则水样中氮的含量是
2 800cV
2 800cV
mg?L-1(用含c、V的表达式表示).I、卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物.
(1)①HClO4、②HIO4、③H5IO6 的酸性由强到弱的顺序为
(2)卤素互化物如BrI、ICl等与卤素单质结构相似、性质相近.Cl2、BrI、ICl沸点由高到低的顺序为
(3)气态氟化氢中存在二聚分子(HF)2,这是由于
(4)I3+(可看成II2+)属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为
(5)卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式为
II.氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质.
(1)出N2H62+在足量碱性溶液中反应的离子方程式
(2)NH2-的电子式为
 .
.
(3)写出两种由多个原子组成的含有与N3-电子数相同的物质的化学式
(4)等电子数的微粒往往具有相似的结构,试预测N3-的构型
(5)据报道,美国科学家1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”.迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形.如果5个N结合后都达到8电子结构,且含有2个N≡N键.则“N5”分子碎片 所带电荷是
查看习题详情和答案>>
(1)①HClO4、②HIO4、③H5IO6 的酸性由强到弱的顺序为
①②③
①②③
(填序号).(2)卤素互化物如BrI、ICl等与卤素单质结构相似、性质相近.Cl2、BrI、ICl沸点由高到低的顺序为
BrI>ICl>Cl2
BrI>ICl>Cl2
.(3)气态氟化氢中存在二聚分子(HF)2,这是由于
HF分子间形成氢键
HF分子间形成氢键
.(4)I3+(可看成II2+)属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为
V形
V形
.(5)卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式为
RbCl
RbCl
.II.氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质.
(1)出N2H62+在足量碱性溶液中反应的离子方程式
N2H62++2OH-=N2H4+2H2O
N2H62++2OH-=N2H4+2H2O
.(2)NH2-的电子式为


(3)写出两种由多个原子组成的含有与N3-电子数相同的物质的化学式
N2O、CO2
N2O、CO2
.(4)等电子数的微粒往往具有相似的结构,试预测N3-的构型
直线型
直线型
.(5)据报道,美国科学家1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”.迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形.如果5个N结合后都达到8电子结构,且含有2个N≡N键.则“N5”分子碎片 所带电荷是
一个单位正电荷
一个单位正电荷
.