网址:http://m.1010jiajiao.com/timu3_id_435127[举报]
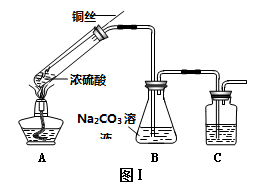
①写出试管内发生反应的化学方程式___________。
②B中混合液被气流搅动,反应一段时同后.硫粉的量逐渐减少。当B中溶液的pH接近7时就停止加热,理由是________________;装置C的作用是_______________。
③过滤B中的混合液,将滤液经过___________、____________、过滤、洗涤、烘干,得到产品。
(2)饱和Na2CO3溶液吸收少量SO2后所得溶液呈弱碱性。含有OH-、SO32-、HCO3-等阴离子。请设计试验方案,证明“滤液”中存在SO32-、HCO3-,写出实验步骤、预期现象和结论。
限选仪器及试剂:pH计、小烧杯、试管、带塞导气管、滴管、玻璃棒、过滤装置和滤纸;2 mol·L-1、1 mol·L-1 BaCl2溶液、l mol·L-1Ba(NO3)2溶液、品红溶液、紫色石葛蕊试液、澄清石灰水等。
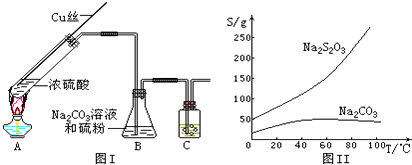
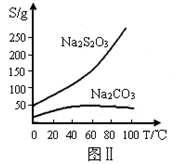
(1)Na2S2O3?5H2O的制备:
①写出试管内发生反应的化学方程式:
②B中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少.当B中溶液的pH接近7时就停止加热,理由是
③过滤B中的混合液,将滤液经过
(2)饱和Na2CO3溶液吸收少量SO2后所得溶液呈弱碱性,含有OH-、SO32-、HCO3-等阴离子.
请设计试验方案,证明“滤液”中存在SO32-、HCO3-,在答题卡上写出实验步骤、预期现象和结论.
限选仪器及试剂:pH计、小烧杯、试管、带塞导气管、滴管、玻璃棒、过滤装置和滤纸;2mol/L盐酸、1mol/LBaCl2溶液、1 mol/LBa(NO3)2溶液、品红溶液、紫色石蕊试液、澄清石灰水等.
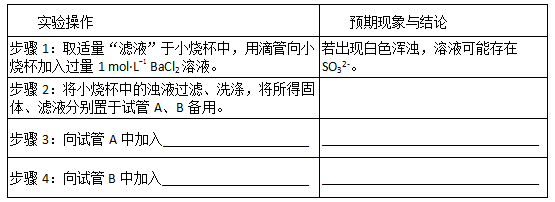
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“滤液”于小烧杯中,用滴管向小烧杯加入过量l mol/L BaCl2溶液. | 若出现白色浑浊,溶液可能存在SO32-. |
| 步骤2:将小烧杯中的浊液过滤、洗涤,将所得固体、滤液分别置于试管A、B备用. | / |
| 步骤3:向试管A中加入 |
|
| 步骤4:向试管B中加入 |
(17分)
I.(1)亚硫酸钠和碘酸钾在酸性溶液中发生以下反应:
Na2SO3+ KIO3+ H2SO4—— Na2SO4+ K2SO4+ I2+ H2O
①配平上面的氧化还原反应方程式,将计量数填在方框内。
②其中氧化剂是 ,若反应中有5 mol电子转移,则生成的碘是 mol。
(2)0.3 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,乙硼烷燃烧热的热化学方程式为 。
II.含氰化物(有CN-)的废水危害大,CN-的含量为0.01mol/L~0.04mol/L就能毒杀鱼类。其处理方法是用氧化法使其转化为低毒的氰酸钾(KCNO),氧化剂常用次氯酸盐;而生成的CNO-可进一步降解为能直接排放到空气中的无毒气体。近期研究将把某些导体的小粒悬浮在溶液中,在光的作用下,在小粒和溶液界面发生氧化还原反应。但小粒的质量和性质不发生变化,如二氧化钛(TiO2)小粒表面就可以破坏氰化物等有毒废物。
(1)二氧化钛在上述反应中的作用是 。
(2)CNO-经进一步处理后产生的两种无毒气体应该是 和 。
(3)若用NaClO溶液处理NaCN的废液,产生另外两种盐,其化学方程式为 。
查看习题详情和答案>>
(17分)
I.(1)亚硫酸钠和碘酸钾在酸性溶液中发生以下反应:
Na2SO3+ KIO3+ H2SO4—— Na2SO4+ K2SO4+ I2+ H2O
①配平上面的氧化还原反应方程式,将计量数填在方框内。
②其中氧化剂是 ,若反应中有5 mol电子转移,则生成的碘是 mol。
(2)0.3 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,乙硼烷燃烧热的热化学方程式为 。
II.含氰化物(有CN-)的废水危害大,CN-的含量为0.01mol/L~0.04mol/L就能毒 杀鱼类。其处理方法是用氧化法使其转化为低毒的氰酸钾(KCNO),氧化剂常用次氯酸盐;而生成的CNO-可进一步降解为能直接排放到空气中的无毒气体。近期研究将把某些导体的小粒悬浮在溶液中,在光的作用下,在小粒和溶液界面发生氧化还原反应。但小粒的质量和性质不发生变化,如二氧化钛(TiO2)小粒表面就可以破坏氰化物等有毒废物。
杀鱼类。其处理方法是用氧化法使其转化为低毒的氰酸钾(KCNO),氧化剂常用次氯酸盐;而生成的CNO-可进一步降解为能直接排放到空气中的无毒气体。近期研究将把某些导体的小粒悬浮在溶液中,在光的作用下,在小粒和溶液界面发生氧化还原反应。但小粒的质量和性质不发生变化,如二氧化钛(TiO2)小粒表面就可以破坏氰化物等有毒废物。
(1)二氧化钛在上述反应中的作用是 。
(2)CNO-经进一步处理后产生的两种无毒气体应该是 和 。
(3)若用NaClO溶液处理NaCN的废液,产生另外两种盐,其化学方程式为 。
(17分)
I.(1)亚硫酸钠和碘酸钾在酸性溶液中发生以下反应:
Na2SO3+ KIO3+ H2SO4—— Na2SO4+ K2SO4+ I2+ H2O
①配平上面的氧化还原反应方程式,将计量数填在方框内。
②其中氧化剂是 ,若反应中有5 mol电子转移,则生成的碘是 mol。
(2)0.3 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,乙硼烷燃烧热的热化学方程式为 。
II.含氰化物(有CN-)的废水危害大,CN-的含量为0.01mol/L~0.04mol/L就能毒杀鱼类。其处理方法是用氧化法使其转化为低毒的氰酸钾(KCNO),氧化剂常用次氯酸盐;而生成的CNO-可进一步降解为能直接排放到空气中的无毒气体。近期研究将把某些导体的小粒悬浮在溶液中,在光的作用下,在小粒和溶液界面发生氧化还原反应。但小粒的质量和性质不发生变化,如二氧化钛(TiO2)小粒表面就可以破坏氰化物等有毒废物。
(1)二氧化钛在上述反应中的作用是 。
(2)CNO-经进一步处理后产生的两种无毒气体应该是 和 。
(3)若用NaClO溶液处理NaCN的废液,产生另外两种盐,其化学方程式为 。
查看习题详情和答案>>