网址:http://m.1010jiajiao.com/timu3_id_434940[举报]
(18分)1.已知一般钾盐均为可溶性的强电解质。在某溶液中可发生下列反应: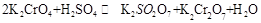
(1)试将上述反应改写成离子议程式
(2)该离子反应的平衡常数表达式为:K= ;
(3)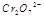 在水溶液中为红色,
在水溶液中为红色,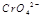 在水溶液中为黄色。某条件下该反应建立平衡后,体系为两种离子的混合液,颜色为橙色。
在水溶液中为黄色。某条件下该反应建立平衡后,体系为两种离子的混合液,颜色为橙色。
若加水将其稀释,溶液颜色将偏 (红、黄)原因是
;
若在在上述平衡体系的溶液中中加入硫酸钾固体体系颜色有何变化?为什么?
Ⅱ.固定和利用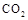 ,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用
,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用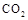 来生产甲醇燃料的方法,该方法的化学方程式是:
来生产甲醇燃料的方法,该方法的化学方程式是:
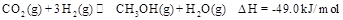
某科学实验将6mol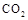 和8molH
和8molH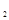 充入一容积为2L的密闭容器中,测得H
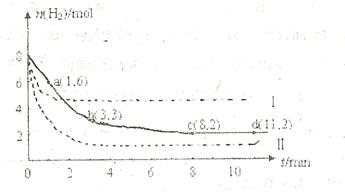
充入一容积为2L的密闭容器中,测得H 的物质的量随时间变化如右图中实线所示(图中字母后数字表示对应的坐标):
的物质的量随时间变化如右图中实线所示(图中字母后数字表示对应的坐标):
问题:
(1)由图分析,在下列时间段内反应速率最快的时间段是 (填答案编号)。
a.0~1min b.1~3min c.3~8min d.8~11min
(2)仅改变某一条件再进行实验,测得H 的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是
,曲线Ⅱ改变的条件可能是
的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是
,曲线Ⅱ改变的条件可能是
。
(3)下列表述能表示该反应已达平衡的是 (填答案编号)
a.容器内压强不再改变 b.容器内气体的密度不再改变
c.容器内气体平均摩尔质量不再改变 d.容器内各物质的物质的量相等
查看习题详情和答案>>
(18分)1.已知一般钾盐均为可溶性的强电解质。在某溶液中可发生下列反应:![]()
(1)试将上述反应改写成离子议程式
(2)该离子反应的平衡常数表达式为:K= ;
(3)![]() 在水溶液中为红色,
在水溶液中为红色,![]() 在水溶液中为黄色。某条件下该反应建立平衡后,体系为两种离子的混合液,颜色为橙色。
在水溶液中为黄色。某条件下该反应建立平衡后,体系为两种离子的混合液,颜色为橙色。
若加水将其稀释,溶液颜色将偏 (红、黄)原因是
;
若在在上述平衡体系的溶液中中加入硫酸钾固体体系颜色有何变化?为什么?
Ⅱ.固定和利用![]() ,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用
,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用![]() 来生产甲醇燃料的方法,该方法的化学方程式是:
来生产甲醇燃料的方法,该方法的化学方程式是:
![]()
某科学实验将6mol![]() 和8molH
和8molH 充入一容积为2L的密闭容器中,测得H
充入一容积为2L的密闭容器中,测得H![]() 的物质的量随时间变化如右图中实线所示(图中字母后数字表示对应的坐标):
的物质的量随时间变化如右图中实线所示(图中字母后数字表示对应的坐标):
问题:
(1)由图分析,在下列时间段内反应速率最快的时间段是 (填答案编号)。
a.0~1min b.1~3min c.3~8min d.8~11min
(2)仅改变某一条件再进行实验,测得H![]() 的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是 ,曲线Ⅱ改变的条件可能是
的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是 ,曲线Ⅱ改变的条件可能是
。
(3)下列表述能表示该反应已达平衡的是 (填答案编号)
a.容器内压强不再改变 b.容器内气体的密度不再改变
c.容器内气体平均摩尔质量不再改变 d.容器内各物质的物质的量相等
查看习题详情和答案>>
(18分)1.已知一般钾盐均为可溶性的强电解质。在某溶液中可发生下列反应:
(1)试将上述反应改写成离子议程式
(2)该离子反应的平衡常数表达式为:K= ;
(3) 在水溶液中为红色,
在水溶液中为红色,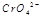 在水溶液中为黄色。某条件下该反应建立平衡后,体系为两种离子的混合液,颜色为橙色。
在水溶液中为黄色。某条件下该反应建立平衡后,体系为两种离子的混合液,颜色为橙色。
若加水将其稀释,溶液颜色将偏 (红、黄)原因是
 ;
;
若在在上述平衡体系的溶液中中加入硫酸钾固体体系颜色有何变化?为什么?

Ⅱ.固定和利用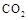 ,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用
,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用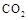 来生产甲醇燃料的方法,该方法的化学方程式是:
来生产甲醇燃料的方法,该方法的化学方程式是: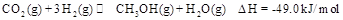
某科学实验将6mol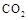 和8molH
和8molH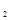 充入一容积为2L的密闭容器中,测得H
充入一容积为2L的密闭容器中,测得H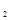 的物质的量随时间变化如右图中实线所示(
的物质的量随时间变化如右图中实线所示( 图中字母后数字表示对应的坐标):
图中字母后数字表示对应的坐标):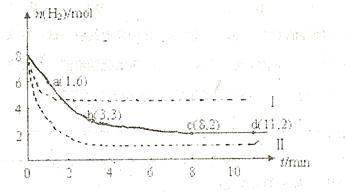
问题:
(1)由图分析,在下列时间段内反应速率最快的时间段是 (填答案编号)。
a.0~1min b.1~3min c.3~8min d.8~11min
(2)仅改变某一条件再进行实验,测得H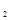 的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是 ,曲线Ⅱ改变的条件可能是
的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是 ,曲线Ⅱ改变的条件可能是
。
(3)下列表述能表示该反应已达平衡的是 (填答案编号)
a.容器内压强不再改变 b.容器内气 体的密度不再改变
体的密度不再改变
c.容器内气体平均摩尔质量不再改变 d.容器内各物质的物质的量相等
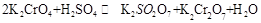
(1)试将上述反应改写成离子议程式
(2)该离子反应的平衡常数表达式为:K= ;
(3)
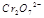 在水溶液中为红色,
在水溶液中为红色,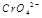 在水溶液中为黄色。某条件下该反应建立平衡后,体系为两种离子的混合液,颜色为橙色。
在水溶液中为黄色。某条件下该反应建立平衡后,体系为两种离子的混合液,颜色为橙色。若加水将其稀释,溶液颜色将偏 (红、黄)原因是
 ;
;若在在上述平衡体系的溶液中中加入硫酸钾固体体系颜色有何变化?为什么?

Ⅱ.固定和利用
 ,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用
,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用 来生产甲醇燃料的方法,该方法的化学方程式是:
来生产甲醇燃料的方法,该方法的化学方程式是: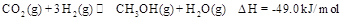
某科学实验将6mol
 和8molH
和8molH 充入一容积为2L的密闭容器中,测得H
充入一容积为2L的密闭容器中,测得H 的物质的量随时间变化如右图中实线所示(
的物质的量随时间变化如右图中实线所示( 图中字母后数字表示对应的坐标):
图中字母后数字表示对应的坐标):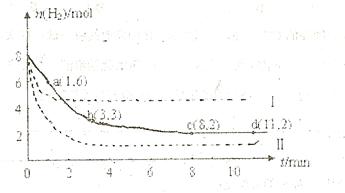
问题:
(1)由图分析,在下列时间段内反应速率最快的时间段是 (填答案编号)。
a.0~1min b.1~3min c.3~8min d.8~11min
(2)仅改变某一条件再进行实验,测得H
 的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是 ,曲线Ⅱ改变的条件可能是
的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是 ,曲线Ⅱ改变的条件可能是。
(3)下列表述能表示该反应已达平衡的是 (填答案编号)
a.容器内压强不再改变 b.容器内气
 体的密度不再改变
体的密度不再改变c.容器内气体平均摩尔质量不再改变 d.容器内各物质的物质的量相等
甲醇是一种非常好的燃料。熔点-97.8°C,沸点64.5°C。一定条件下,CO与H2反应可制得甲醇:CO+2H2![]() CH3OH
CH3OH
图1表示该反应进行过程中的能量变化;
图2表示100°C,在体积为2L的恒容容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。
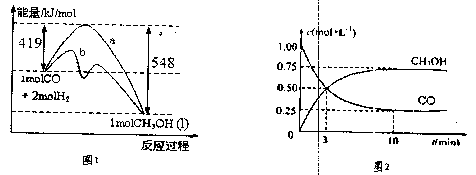
(1)已知CO的燃烧热为283kJ/mol,H2的燃烧热为285.8kJ/mol,写出表示CH3OH燃烧热的热化学方程式 。
(2)根据上图2计算:该温度下,反应CO(g)+2H(g)![]() CH3OH(g)的平衡常数为 10min后,容器内的压强变为原来的 倍;改变下列条件,能提高CO转化率的是 。
CH3OH(g)的平衡常数为 10min后,容器内的压强变为原来的 倍;改变下列条件,能提高CO转化率的是 。
A.降低温度 B.加催化剂
C.充入氩气,使体系压强增大 D.再充入1molCO和2molH2
E.恒温恒容改为恒温恒压
(3)已知:CH3OH可以在一定条件下转化为HCOOH,HCOOH和CH3COOH性质相似。25°C,0.1mol/L的HCOOH溶液的pH>1。室温下,向0.1mol/L的HCOOH中加NaOH。
①当溶液中离子浓度关系满足c(HCOO-)<c(Na+)时,则反应的情况可能为 ;
A.NaOH不足,HCOOH剩余 B.HCOOH与NaOH恰好完全反应
C.NaOH过量
②若加入过量的NaOH,在加入NaOH的过程中,H2O的电离程度如何变? 。
查看习题详情和答案>>