网址:http://m.1010jiajiao.com/timu3_id_434674[举报]
试回答: SOCl2的作用是____。
Ⅱ.一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp=cm(An+)×cn(Bn-),称为难溶电解质的溶度积。
(1)在25℃时,AgCl的白色悬浊液中,依次加入等浓度的Kl溶液和Na2S溶液, 观察到的现象是____。
(2)下列叙述不正确的是____(填字母)。
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同
C.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同
(1)试写出它与水完全反应的化学方程式:_______________________。
(2)设计一些简单的实验来验证你写的化学方程式是正确的。(只需给出实验原理,无须描述实验仪器的操作。
查看习题详情和答案>> Ⅰ.下列实验操作或对实验事实的描述不正确的是
Ⅰ.下列实验操作或对实验事实的描述不正确的是①配制一定浓度的溶液时,俯视容量瓶的刻线,会使配制的浓度偏高
②向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体
③仅用蒸馏水可鉴别出蔗糖、硫酸铜、碳酸钙三种粉末
④实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉
⑤测溶液大致的pH:用玻璃棒蘸取溶液滴在湿润的pH试纸上,与标准比色卡对照
Ⅱ.实验室有一份混有少量碳酸钙杂质的碳酸钡样品.分离并提纯碳酸钡的实验步骤如下,请根据要求填空[右图为Ba(OH)2和Ca(OH)2的溶解度曲线]:
(1)高温灼烧碳酸钡和碳酸钙的混合物,直至完全分解.所需仪器除三脚架、泥三角、酒精灯外,还需要的仪器有
(2)将灼烧后的固体混合物置于80℃的热水中,制成氢氧化钡的热饱和溶液.为减少Ba(OH)2的损失并除去不溶物得到Ba(OH)2固体,写出所进行的主要操作步骤的名称
(3)将(2)中得到的Ba(OH)2固体溶于水制成溶液再往其中滴入2滴酚酞,通入CO2,请简述Ba(OH)2恰好全部生成碳酸钡沉淀的判断方法
(4)滤出碳酸钡沉淀,经
(8分)江苏连云港开发硅产业比较发达,粗硅提纯经常用“三氯氢硅法”。将干燥的硅粉加入合成炉中,与通入的干燥氯化氢气体在280~330℃有氯化亚铜催化剂存在下进行氯化反应,反应气体旋风分离除去杂质,再用氯化钙冷冻盐水将气态三氯氢硅冷凝成液体,经粗馏塔蒸馏和冷凝,除去高沸物和低沸物,再经精馏塔蒸馏和冷凝,得到精制三氯氢硅液体。纯度达到七个“9”以上,杂质含量小于1×10-7,硼要求在0.5×10-9以下。提纯后的三氯氢硅送入不锈钢制的还原炉内,用超纯氢气作还原剂,在1050~1100℃还原成硅,并以硅芯棒为载体沉积而得多晶硅成品。其反应式如下:
Ⅰ H2+Cl2 =" 2HCl"
Ⅱ Si(粗)+3HCl(g)= SiHCl3(l)+H2(g)
Ⅲ SiHCl3(l) +H2(g) = Si(纯)+3HCl(g)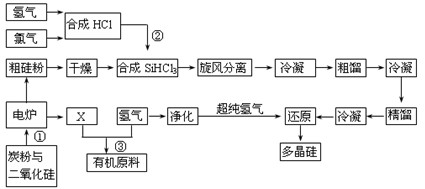
据以上材料回答问题:
(1)电炉中发生反应后排出气体X的成份 (填化学式)。
(2)目前提倡“低碳类经济”,CO2的吸收转化成有机物可有效实现碳循环,是节能减排的有效措施。某物质y的核磁共振氢谱只有一个峰,与CO2可催化加聚生成自然降解的
塑料聚碳酸酯,其反应方程式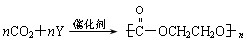 则Y的结构简式为 。
则Y的结构简式为 。
(3)在上述流程中可以循环使用的物质是 。(填名称)
(4)SiH4化学性质比较活泼,它在空气中自燃,有强还原性,在碱存在下迅速水解,由SiH4为原料进行氮化来制备Si3N4纳米材料,则你认为该材料中最大可能存在的杂质
(填化学式)。
(5)已知化学键如表
则下述反应 SiCl4(g)+2H2(g) Si(s)+4HCl(g)
Si(s)+4HCl(g)
该反应的反应热 △H= kJ·mol-1