摘要:1.HCN为剧毒物质.受热水解为甲酰胺.后者进一步水解为甲酸铵.写出这二步反应式.你认为酸性还是碱性有利于水解反应的进行.
网址:http://m.1010jiajiao.com/timu3_id_434667[举报]
海葵毒素是从海洋生物中出来的一种剧毒物质.科学家用了8年时间才完成了海葵毒素的全合成,其结构简式如图所示,(Me表示甲基).实验测得海葵毒素含氮元素的质量分数为0.01569.已知海葵的分子中C、O、N的原子个数之比为43:18:1,试通过计算确定海葵毒素的分子式 .
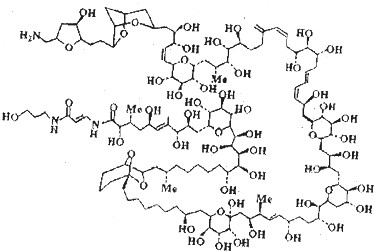
查看习题详情和答案>>

黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用做食盐添加剂(抗结剂),我国卫生部规定食盐中黄血盐的最大使用量为10mg?kgˉ1.黄血盐易溶于水,在水溶液中会电离出K+和[Fe(CN)6]4ˉ,其中CNˉ的电子式为 .它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O
.它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O
2K2SO4+FeSO4+3(NH4)2SO4+6CO↑
(1)上述反应是否为氧化还原反应?
(2)食盐经长时间火炒,“亚铁氰化钾”名称前的“亚铁”就去掉了,变成了剧毒物质氰化钾,这是因为黄血盐在超过4000C时会分解,试配平该反应的化学方程式:
(3)黄血盐可与高锰酸钾溶液反应,其化学方程式为:
K4Fe(CN)6+KMnO4+H2SO4→KHSO4+Fe2(SO4)3+MnSO4+HNO3+CO2↑+H2O(未配平)
①该反应的氧化产物有
②若有1mol K4Fe(CN)6被高锰酸钾氧化,则消耗高锰酸钾的物质的量为
查看习题详情和答案>>
 .它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O
.它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O
| ||
(1)上述反应是否为氧化还原反应?
不是
不是
(填“是”或“不是”).(2)食盐经长时间火炒,“亚铁氰化钾”名称前的“亚铁”就去掉了,变成了剧毒物质氰化钾,这是因为黄血盐在超过4000C时会分解,试配平该反应的化学方程式:
3
3
K4Fe(CN)
| ||
12
12
KCN+1
1
Fe3C+5C+3N2↑(3)黄血盐可与高锰酸钾溶液反应,其化学方程式为:
K4Fe(CN)6+KMnO4+H2SO4→KHSO4+Fe2(SO4)3+MnSO4+HNO3+CO2↑+H2O(未配平)
①该反应的氧化产物有
Fe2(SO4)3、HNO3、CO2
Fe2(SO4)3、HNO3、CO2
(填化学式).②若有1mol K4Fe(CN)6被高锰酸钾氧化,则消耗高锰酸钾的物质的量为
2.2
2.2
mol.氰化物有剧毒,冶金工业会产生大量含氰化物的废水,其中氰化物以CN-等形式存在于废水中.某化学小组同学对含氰化物废水处理进行研究.
I.查阅资料:含氰化物的废水破坏性处理方法.
利用强氧化剂将氰化物氧化为无毒物质,如以TiO2为催化剂用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等.
II.实验验证:破坏性处理CN-的效果.
化学兴趣小组的同学在密闭系统中用如图装置进行实验,以测定CN-被处理的百分率,实验步骤如下:
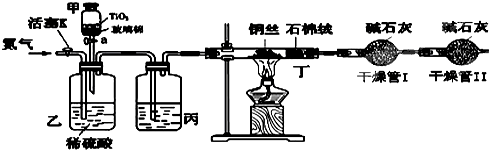
步骤1:取一定量废水进行加热蒸发、浓缩.
步骤2:取浓缩后含CN-离子的废水与过量NaClO溶液的混合液共200mL(设其中CN-的浓度为0.2mol?L-1)倒入甲中,塞上橡皮塞.
步骤3:
步骤4:打开甲上的橡皮塞和活塞,使甲中溶液全部放入乙中,关闭活塞.
步骤5:打开活塞K,通一段时间N2,关闭活塞K.
步骤6:实验完成后测定干燥管I(含碱石灰)的质量m2(实验前干燥管I(含碱石灰)的质量m1)
回答下列问题:
(1)在破坏性处理方法中,在酸性条件下NaClO和CNO-反应的离子方程式
(2)完成步骤3
(3)丙装置中的试剂是
(4)干燥管Ⅱ的作用是
(5)请简要说明实验中通入N2的目的是
(6)若干燥管Ⅰ中碱石灰增重1.408g,则该实验中测得CN-被处理的百分率为
查看习题详情和答案>>
I.查阅资料:含氰化物的废水破坏性处理方法.
利用强氧化剂将氰化物氧化为无毒物质,如以TiO2为催化剂用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等.
II.实验验证:破坏性处理CN-的效果.
化学兴趣小组的同学在密闭系统中用如图装置进行实验,以测定CN-被处理的百分率,实验步骤如下:

步骤1:取一定量废水进行加热蒸发、浓缩.
步骤2:取浓缩后含CN-离子的废水与过量NaClO溶液的混合液共200mL(设其中CN-的浓度为0.2mol?L-1)倒入甲中,塞上橡皮塞.
步骤3:
点燃酒精灯对丁装置加热
点燃酒精灯对丁装置加热
.步骤4:打开甲上的橡皮塞和活塞,使甲中溶液全部放入乙中,关闭活塞.
步骤5:打开活塞K,通一段时间N2,关闭活塞K.
步骤6:实验完成后测定干燥管I(含碱石灰)的质量m2(实验前干燥管I(含碱石灰)的质量m1)
回答下列问题:
(1)在破坏性处理方法中,在酸性条件下NaClO和CNO-反应的离子方程式
2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O
2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O
.(2)完成步骤3
点燃酒精灯对丁装置加热
点燃酒精灯对丁装置加热
.(3)丙装置中的试剂是
浓硫酸
浓硫酸
,丁装置的目的是除去Cl2
除去Cl2
.(4)干燥管Ⅱ的作用是
防止空气中的水和CO2进入干燥管I中影响对CO2的测量
防止空气中的水和CO2进入干燥管I中影响对CO2的测量
.(5)请简要说明实验中通入N2的目的是
使装置中的CO2全部被排到干燥管I中被吸收,减少误差
使装置中的CO2全部被排到干燥管I中被吸收,减少误差
.(6)若干燥管Ⅰ中碱石灰增重1.408g,则该实验中测得CN-被处理的百分率为
80%
80%
. ,已知它的二氯代物有10种,则 其六氯代物有( )
,已知它的二氯代物有10种,则 其六氯代物有( )