网址:http://m.1010jiajiao.com/timu3_id_434632[举报]

回答:
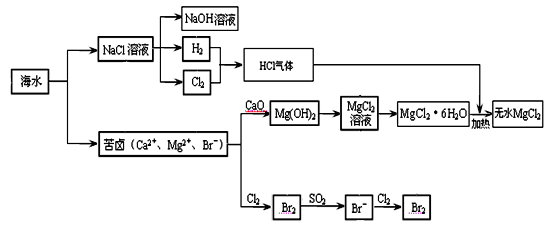
(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、
(2)某同学在实验室模拟氯碱工业的生产原理电解饱和食盐水.用玻璃棒蘸浓氨水检验阳极产生的气体,发现产生大量白烟.阳极生成的气体是
(3)制取MgCl2的过程中涉及反应:MgCl2?6H2O
| ||
(4)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收转化为Br-,反复多次,以达到富集溴的目的.由海水提溴过程中的反应可得出Cl-、SO2、Br-还原性由强到弱的顺序是
(5)工业上也可以用Na2CO3溶液吸收吹出的Br2,生成溴化钠和溴酸钠,同时有CO2放出.最后再用H2SO4处理得到Br2,最后一步反应的离子方程式是
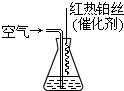 (2013?海淀区二模)氮化硅膜与二氧化硅膜相比较具有表面化学性能稳定等优点,故氮化硅膜可用于半导体工业.为生成氮化硅膜,可以用NH3和SiH4(硅烷)在一定条件下反应并在600℃的加热基板上生成氮化硅膜:
(2013?海淀区二模)氮化硅膜与二氧化硅膜相比较具有表面化学性能稳定等优点,故氮化硅膜可用于半导体工业.为生成氮化硅膜,可以用NH3和SiH4(硅烷)在一定条件下反应并在600℃的加热基板上生成氮化硅膜:3SiH4+4NH3
| ||
(1)以硅化镁为原料制备硅烷的反应和工业流程如下:
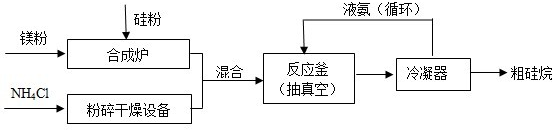
反应原理:4NH4Cl+Mg2Si
| ||
①NH4Cl的化学键类型有


②上述生产硅烷的过程中液氨的作用是
③氨气也是重要的工业原料,写出氨气发生催化氧化反应生成NO的化学方程式
| ||
| △ |
| ||
| △ |
在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,白烟的主要成分是
(2)三硅酸镁(Mg2Si3O8?nH2O)难溶于水,在医药上可做抗酸剂.它除了可以中和胃液中多余酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激.三硅酸镁与盐酸反应的化学方程式为
(10分)MnO2和锌是制造干电池的主要原料。某地有软锰矿和闪锌矿两座矿山,它们的主要成份为:
软锰矿:MnO2含量≥65% Al2O3含量为4%
闪锌矿:ZnS含量≥80% FeS、CuS、 CdS含量各为2%
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液经净化后再进行电解,MnO2在电解池的阳极析出。
电解锌的传统生产工艺为:闪锌矿高温氧化脱硫再用热还原法还原得粗锌:
2ZnS+O22ZnO+2SO2 2C+O2
2CO ZnO+CO
Zn(g)+CO2
将用热还原法制得的粗锌溶于硫酸,再电解ZnSO4溶液可生产纯度为99.95%的锌。
现在生产MnO2和锌的新工艺主要是通过电解获得MnO2和锌,副产品是硫、金属铜和镉。简化流程杠图如下:
试回答下列问题:
(1)Zn的原子序数为30,它在元素周期表中的位置是 ;软锰矿、闪锌矿粉未与硫酸溶液共热时析出硫的反应为氧化-还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,据此写出MnO2在酸性溶液中分别FeS发生氧化-还原反应的化学方程式 ;软锰矿中Al2O3溶于硫酸的离子方程式 ;由滤渣甲回收硫黄的实验方法是 ;
(2)用离子方程式表示浸出液A与适量Zn粉作用得到滤液B与滤渣乙的过程 ______________________________________________________________________。
(3)滤渣丙的化学成分是 ;
(4)用铁和铂电极电解MnSO4和ZnSO4的混合溶液可以得到Zn和MnO2,电解时,铁做 极,铁极发生的电极反应为 。
查看习题详情和答案>>
氮化硅膜与二氧化硅膜相比较具有表面化学性能稳定等优点,故氮化硅膜可用于半导体工业。为生成氮化硅膜,可以用NH3和SiH4(硅烷)在一定条件下反应并在600℃的加热基板上生成氮化硅膜:
3 SiH4+4NH3 Si3N4+12H2
Si3N4+12H2
(1)以硅化镁为原料制备硅烷的反应和工业流程如下:
反应原理:4NH4Cl+Mg2Si 4NH3↑+SiH4↑+2MgCl2(△H
< 0)
4NH3↑+SiH4↑+2MgCl2(△H
< 0)

①NH4Cl的化学键类型有____________,SiH4电子式为_______________。
②上述生产硅烷的过程中液氨的作用是________________________。
③氨气也是重要的工业原料,写出氨气发生催化氧化反应生成NO的化学方程式_______,实验室可利用如图所示装置完成该反应。
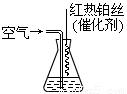
在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,白烟的主要成分是_____________。
(2)三硅酸镁(Mg2Si3O8∙nH2O)难溶于水,在医药上可做抗酸剂。它除了可以中和胃液中多余酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激。三硅酸镁与盐酸反应的化学方程式为_______________________________。将0.184 g三硅酸镁加到50 mL 0.1 mol/L盐酸中,充分反应后,滤去沉淀,以甲基橙为指示剂,用0.1 mol/L NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30 mL,则Mg2Si3O8∙nH2O的n值为_________。(注:Mg2Si3O8的摩尔质量为260 g/mol)
查看习题详情和答案>>
海洋是巨大的化学资源宝库。下面是海水化学资源综合利用的部分流程图:
回答:
(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、__ ___(填试剂化学式),然后__ ___(填操作名称)。在溶液中再加适量 (填试剂),加热蒸干溶液即得到精盐。
(2)某同学在实验室模拟氯碱工业的生产原理电解饱和食盐水。用玻璃棒蘸浓氨水检验阳极产生的气体,发现产生大量白烟。阳极生成的气体是 ,白烟的主要成分是 。
(3)制取MgCl2的过程中涉及反应:MgCl2·6H2O MgCl2 + 6H2O,该反应要在HCl气流中进行,原因是 。
MgCl2 + 6H2O,该反应要在HCl气流中进行,原因是 。
(4)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收转化为Br-,反复多次,以达到富集溴的目的。由海水提溴过程中的反应可得出Cl-、SO2、Br-还原性由强到弱的顺序是_________。
查看习题详情和答案>>